
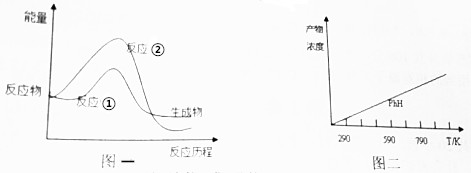
分析 (1)反应物的能量高于生成物,正反应放热;
(2)相同温度下反应,反应的活化能越高,反应速率应越慢;
(3)固定容积的容器中,苯硫酚的浓度随反应进行而增大,到达平衡后浓度最大,而平衡后苯浓度增加,消耗了反应物,导致反应Ⅰ逆向移动,并且,正反应放热,随温度升高平衡逆向移动,苯硫酚的浓度减小.
解答 解:(1)由图1可知,反应①中反应物总能量高于生成物总能量,反应①为放热反应,故答案为:放热;
(2)活化能②>①,活化能越高,单位体积内活化分子数目越小,反应速率应越慢,故反应速率①>②,
故答案为:>;
(3)固定容积的容器中,苯硫酚的浓度随反应进行而增大,到达平衡后浓度最大,而平衡后苯浓度增加,消耗了反应物,导致反应Ⅰ逆向移动,并且,正反应放热,随温度升高平衡逆向移动,苯硫酚的浓度减小,苯硫酚的浓度随温度变化的曲线图为: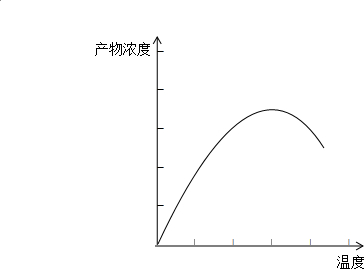 ,
,
故答案为: .
.
点评 本题考查化学反应速率及化学平衡图象综合应用、化学反应能量变化等,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铁在氧气中燃烧 | |
| B. | 氢氧化钡晶体[Ba(OH)2•8H2O]与氯化铵晶体混合 | |
| C. | 锌与稀硫酸反应 | |
| D. | 氢氧化钡溶液与硫酸氢钠溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | $\frac{Vd}{MV+22400}$ | B. | $\frac{1000Vd}{MV+22400}$ | C. | $\frac{1000VdM}{MV+22400}$ | D. | $\frac{MV}{22.4(V+1)d}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 200 | 300 | 400 |
| 气体体积/Ml | 224 | 280 | 280 |
| 剩余固体/mg | 14 | 67.5 | 167.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 等体积、等浓度的稀溶液Ba(OH)2与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若容器底部没有固体,则溶液中只有Cu2+ | |
| B. | 若容器底部固体既有铜又有铁,则溶液中只有Fe2+ | |
| C. | 若容器底部固体为铜,则溶液中可能有Cu2+和Fe3+ | |
| D. | 若容器底部无固体,再加入铁粉,溶液中阳离子的种类不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g | B. | 20g | C. | 26g | D. | 28g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com