
第3周期元素的基态原子中,不可能出现d电子,主要依据是
A.能量守恒原理 B.泡利不相容原理
C.洪特规则 D.近似能级图中的顺序3d轨道能量比4s轨道高
科目:高中化学 来源: 题型:
用下图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
| ①中的物质 | ②中的物质 | 预测①的现象 |
| |
| A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 | |
| B | 酚酞溶液 | 浓盐酸 | 无明显变化 | |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 | |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
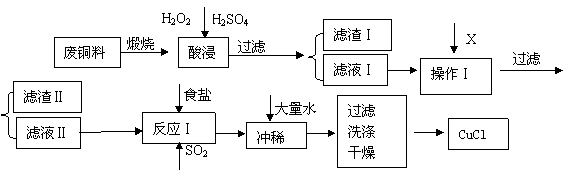
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.8 | 4.7 |
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是: 。
(2)操作Ⅰ为调节溶液的PH值,范围为 ,加入的物质X可以是( )
A、CuO B、Cu(OH)2 C、NaOH 溶液 D、CaCO3
(3)滤渣Ⅱ的主要成分是 。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式:
。
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是: 。
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O  CuOH + H+的平衡常数为: 。
CuOH + H+的平衡常数为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素甲和乙,甲原子的最外层电子数为a,次外层电子数为b;乙原子的M层电子数为(a – b – 1),L层电子数为(a + b)。 则甲、乙两元素形成的化合物具有的性质是
则甲、乙两元素形成的化合物具有的性质是
①与水反应 ②与硫酸反应 ③与氢氧化钠溶液反应 ④与氯气反应
A.①② B.②③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中元素均为中学化学中常见短周期元素,根据表中信息,下列说法不正确的是
| 元素代号 | X | Y | Z | W | N |
| 原子半径/nm | 0.186 | 0.074 | 0.102 | 0.099 | 0.160 |
| 主要化合价 | +1 | -2 | -2、+6 | +7、-1 | +2 |
A.常温下单质与水反应速率:X > N
B.最高价氧化物对应水化物酸性:W > Z
C.X 与W形成的化合物是共价化合物
D.X和Y的单质在一定条件下反应可生成一种淡黄色的固体化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
已知 X、Y、Z、Q、R、E六种元素中,原子序数的大小关系为X<Y<Z<Q<R<E,其结构
或性质信息如下表。
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数。 |
| Y | 原子核外的L层有3个未成对电子。 |
| Z | 在元素周期表的各元素中电负性仅小于氟。 |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子。 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
请根据信息回答有关问题:
(1)元素Y的原子核外共有 种不同运动状态的电子,有 种不同能级的电子。
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号) 。
(3)R的最高化合价为 ;R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是 。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
(4) 元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心离子为(写化学式) ,
配位体为(写化学式) ,x 的值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大。
B. 恒容容器中平衡体系A(g)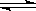 2B(g)中增加A的物质的量,A的转化率增大。
2B(g)中增加A的物质的量,A的转化率增大。
C. 一定条件下反应2AB(g) 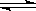 A2(g)+B2(g), 当容器中各组分的体积分数不随时间变化,说明体系达到平衡状态。
A2(g)+B2(g), 当容器中各组分的体积分数不随时间变化,说明体系达到平衡状态。
D. 已知反应A2(g)+2B2(g) 2AB2(g)△H <0, 升高温度,正向反应速率增加,逆向反应速率减小。
2AB2(g)△H <0, 升高温度,正向反应速率增加,逆向反应速率减小。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,正确的是
A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com