
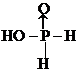 .H3PO2是一元(填“一”、“二”或“三”)酸.
.H3PO2是一元(填“一”、“二”或“三”)酸.分析 (1)根据氧化还原反应中得失电子数相等配平.此反应的配平技巧是先配生成物系数,再配反应物系数.
(2)由题目信息看,白磷与过量的NaOH溶液反应生成产物之一是NaH2PO2,可见次磷酸是一元酸;
(3)反应中Ni元素的化合价降低,P元素的化合价升高,结合电子、电荷守恒及原子守恒分析;
(4)结合两个反应及物质的量关系计算;
(5)根据题目信息,若滴加NaOH溶液后恰好中和生成NaH2PO2,需NaOH溶液的体积是100mL,此时溶液pH>7.若使溶液呈中性,则滴加的NaOH溶液体积应小于100mL.由于溶液最终呈中性,且电荷守恒,结合中性及电荷守恒分析离子浓度大小.
解答 解:(1)白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2,结合电子守恒、原子守恒可知化学方程式为P4+3NaOH+3H2O═PH3↑+3NaH2PO2 ,
故答案为:P4+3NaOH+3H2O═PH3↑+3NaH2PO2;
(2)白磷与过量的NaOH溶液反应生成产物之一是NaH2PO2,可见次磷酸是一元酸,即该分子中含有一个羟基,结构为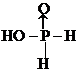
故答案为: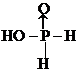
(3)反应①中镍元素的化合价降低了2价,磷元素的化合价升高的2价,由电子、电荷守恒及原子守恒可知,离子反应为Ni2++H2PO2-+H2O═Ni+H2PO3-+2H+,
故答案为:1;1;1H2O;1;1;2H+;
(4)从二个化学镀镍反应分析,若生成1molNi会生成1molH2PO3-,若生成1molP会生成2molH2PO3-,共生成3molH2PO3-,
故答案为:3;
(5)若滴加NaOH溶液后恰好中和生成NaH2PO2,需NaOH溶液的体积是100mL,此时溶液pH>7.若使溶液呈中性,则滴加的NaOH溶液体积应小于100mL.由于溶液最终呈中性,且电荷守恒,所以溶液中离子浓度大小的顺序是c(Na+)=c(H2PO2-)>c(OH-)=c(H+),
故答案为:<;c(Na+)=c(H2PO2-)>c(OH-)=c(H+).
点评 本题考查较综合,涉及氧化还原反应计算、离子浓度比较、物质结构等,综合性较强,侧重分析与应用能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
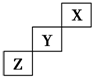
| A. | X、Y、Z三种元素中,X的非金属性最强 | |
| B. | Y的氢化物的稳定性比Z的弱 | |
| C. | Y的最高正化合价为+7 | |
| D. | X的单质不易发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在0.5 mol的CO | B. | 存在0.25 mol的Na2CO3 | ||
| C. | 存在0.125 mol的O2 | D. | 存在0.75 mol的Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同 | |
| B. | 白磷(P4)分子是正四面体结构,故分子中的键角为1090281 | |
| C. | CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相等 | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
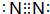 ,Z的原子结构示意图
,Z的原子结构示意图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小为W<X<Y<Z | |
| B. | W与X、Y、Z分别形成最简单化合物中最稳定的是Z | |
| C. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
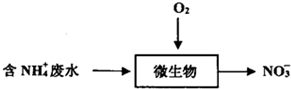
| A. | 生物硝化法处理废水,会导致水体pH逐渐下降:NH4++202=NO3-+2H++H20 | |
| B. | 长期过量使用NH4Cl等铵态化肥,易导致土壤酸化,水体富营养化 | |
| C. | 检验NH4+所需的试剂是浓NaOH溶液,湿润的蓝色石蕊试纸 | |
| D. | 微生物保持活性的pH范围为7〜9,可以加入石灰石来调节水体的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
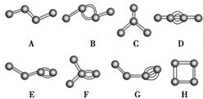 如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.
如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com