
分析 电解水的方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,阳极得到氧气,阴极得到H2、D2,由方程式知:氢气和氧气的体积之比为2:1,进而计算H2、D2的总物质的量、总质量,列方程计算各自物质的量,进而计算水中所含D2O的质量分数.
解答 解:电解水的方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,阳极得到氧气,阴极得到H2、D2,由方程式知:氢气和氧气的体积之比为2:1,故H2、D2的总体积为16.8L×$\frac{2}{3}$=11.2L,物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,氧气的体积为16.8L-11.2L=5.6L,氧气的质量=$\frac{5.6L}{22.4L/mol}$×32g/mol=8g,则H2、D2的总质量为9.25g-8g=1.25g,
设H2、D2的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.5}\\{2x+4y=1.25}\end{array}\right.$
解得x=0.375、y=0.125,
混合气体中H原子和D原子个数之比为0.75mol:0.25mol=3:1,
则溶液中H2O、D2O的物质的量为3:1,
水中所含D2O的质量分数$\frac{1×20}{3×18+1×20}×100%$=27%,
答:水中所含D2O的质量分数27%.
点评 本题以电解原理为载体考查了混合物有关计算、物质的量的有关计算,侧重于学生的分析、计算能力的考查,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
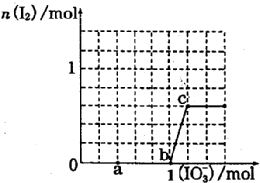 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图.下列说法正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图.下列说法正确的是( )| A. | 反应过程中的氧化产物均为Na2SO4 | |
| B. | a 点时消耗NaHSO3的物质的量为1.0mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l),△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数不相同 | |
| C. | 若用标准状况下4.48L CH4 还原NO2至N2,放出的热量为173.4kJ | |
| D. | 若用标准状况下4.48L CH4 还原NO2至N2,整个过程中转移的电子总数为0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | 元素性质或原子结构 |
| T | 第二层上的电子数是第一层的3倍 |
| R | 与T 同一族 |
| L | L2+与T2-的核外电子数相等 |
| Z | 元素最高正价是+3价,与L同周期 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的速率为L<Z | |
| C. | Z与T形成的化合物具有两性 | |
| D. | L与R通过离子键形成的化合物阴阳离子的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2 | B. | 0.2mol N2 | ||
| C. | 3.01×1023个CO2分子 | D. | 标准状况下11.2L H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,1mol任何气体物质的体积都约为22.4L | |
| B. | 1mol气体的体积约为22.4L | |
| C. | 标准状况下,1molO2和N2混合气(任意比)的体积约为22.4L | |
| D. | 任何条件下,气体的摩尔体积都是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com