
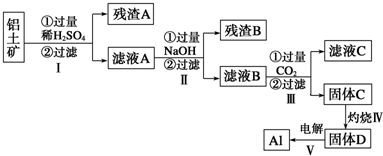
- 2 |
| ||
| ||
- 2 |
| n(Al(OH) 3) |
| V |
| ||
| 0.1 |
| 11.7 |
| 78 |
| 1.1mol |
| 0.1L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| HCl |
| X |
| A、NH3?H2O |
| B、CO2 |
| C、NaOH |
| D、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
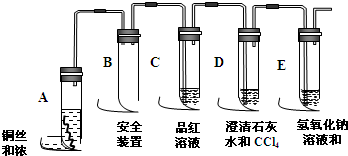
查看答案和解析>>
科目:高中化学 来源: 题型:
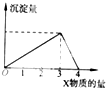 将X气体(或溶液)慢慢通入(或加人)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )
将X气体(或溶液)慢慢通入(或加人)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )| A、X为NaOH溶液,Y为AlCl3溶液 |
| B、X为CO2,Y为Ca(OH)2溶液 |
| C、X为NH3,Y为AlCl3溶液 |
| D、X为HCl溶液,Y为Na[Al(OH)4]溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝可以用来制造耐火坩埚、耐火管和耐高温的实验仪器 |
| B、氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理 |
| C、氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 |
| D、氨气溶于水显碱性,可以用湿润的红色石蕊试纸检验氨气的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al(OH)3是难溶于水的白色沉淀 |
| B、Al(OH)3能吸附水中的悬浮物 |
| C、Al(OH)3能溶于氨水 |
| D、Al(OH)3属于两性氢氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com