
| A. | Na2O2既是氧化剂又是还原剂 | |
| B. | Fe2O3在反应中显氧化性 | |
| C. | 1molNa2O2发生反应,有4mol电子转移 | |
| D. | 在Na2FeO4能消毒杀毒是因其具有强氧化性 |
分析 在反应Fe2O3+3Na2O2═2Na2FeO4+Na2O中,Fe元素化合价升高,由+3价升高为+6价,Fe2O3被氧化为还原剂,O元素化合价降低,由-1价降低为-2价,被还原,Na2O2为氧化剂,根据化合价的变化分析氧化还原反应.
解答 解:A.反应中Fe元素的化合价由+3价升高到+6价,Fe2O3被氧化为还原剂,Na2O2中O元素的化合价由-1价变为-2价,被还原,Na2O2为氧化剂,故A错误;
B.反应中Fe元素的化合价由+3价升高到+6价,Fe2O3被氧化为还原剂,在反应中显还原性,故B错误;
C.Na2O2中O元素的化合价由-1价变为-2价,1molNa2O2发生反应,转移电子的物质的量为1mol×2×1=2mol,故C错误;
D.Na2FeO4中Fe为+6价,其具有强氧化性,所以Na2FeO4能消毒杀毒是因其具有强氧化性,故D正确.
故选D.
点评 本题考查氧化还原反应,为高频考点,题目难度中等,解答本题的关键是正确判断元素的化合价,根据化合价的变化分析氧化还原反应.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+) | |
| B. | pH=7的溶液中:c(Cl-)═c(HS-)+2c(H2S) | |
| C. | c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100 mol•L-1+c(H2S) | |
| D. | c(Cl-)=0.100 mol•L-1的溶液中:c(OH-)-c(H+)=c(H2S)-c(S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
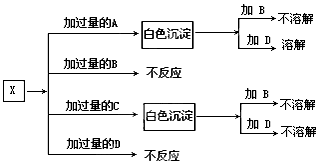 A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种.现利用另一种溶液X,用如下图所示的方法即可将它们确定.
A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种.现利用另一种溶液X,用如下图所示的方法即可将它们确定.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
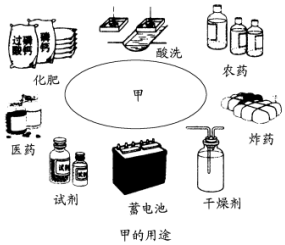 a、b、c是原子序数依次增大的三种常见短周期元素.由a、b、c三元素组成的化合物甲的用途如下图所示.a、b、c三元素之间两两化合可生成化合物乙、丙、丁、戊4种.化合物甲、乙、丙、丁、戊之间也能相互反应.已知乙、戊分别是由a、b两元素按原子个数1:1和2:1组成的化合物.若a、b、c三元素形成的单质(仍用a、b、c表示)和由它们组成的化合物之间的反应关系如下(未配平)
a、b、c是原子序数依次增大的三种常见短周期元素.由a、b、c三元素组成的化合物甲的用途如下图所示.a、b、c三元素之间两两化合可生成化合物乙、丙、丁、戊4种.化合物甲、乙、丙、丁、戊之间也能相互反应.已知乙、戊分别是由a、b两元素按原子个数1:1和2:1组成的化合物.若a、b、c三元素形成的单质(仍用a、b、c表示)和由它们组成的化合物之间的反应关系如下(未配平)查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加氯水和CC14,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H2>△H3>△H1 | C. | △H2>△H1>△H3 | D. | △H3>△H2>△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com