
| 物质 温度 | KMnO4 | CH3COOK | K2SO4 | KCl |
| 20℃ | 6.34 | 217 | 11.1 | 34.2 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
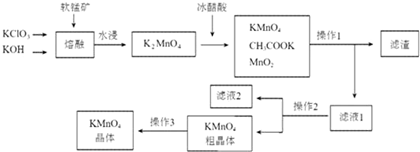
分析 软锰矿中的二氧化锰和加入氯酸钾和氢氧化钾熔融发生氧化还原反应生成锰酸钾、氯化钾和水,锰酸钾中加入冰醋酸自身发生氧化还原反应生成二氧化锰、高锰酸钾和醋酸钾,操作Ⅰ是溶解过滤得到滤渣为二氧化锰,操作Ⅱ是滤液2通过加热浓缩、降温结晶、过滤洗涤得到高锰酸钾粗晶体,所含杂质主要为KCl、CH3COOK等,将高锰酸钾粗晶体溶于水,通过重结晶的方法可以提纯高锰酸钾晶体,用硝酸银溶液可以检验杂质是否除去,
(1)软锰矿中的二氧化锰和加入氯酸钾和氢氧化钾熔融发生氧化还原反应生成锰酸钾、氯化钾和水,结合原子守恒和电子守恒配平书写化学方程式;
(2)K2MnO4溶液中加入冰醋酸发生反应是自身氧化还原反应生成高锰酸钾和二氧化锰,结合电子守恒、电荷守恒和原子守恒书写离子方程式;
(3)操作2是滤液2通过加热浓缩、降温结晶、过滤洗涤得到高锰酸钾粗晶体;
(4)参加反应过程最后又生成的物质可以循环使用;
(5)高锰酸钾粗晶体,所含杂质主要为KCl、CH3COOK等,若用硫酸代替图中的冰醋酸,生成的硫酸钾溶解度小易在晶体中含有更多杂质.
解答 解:软锰矿中的二氧化锰和加入氯酸钾和氢氧化钾熔融发生氧化还原反应生成锰酸钾、氯化钾和水,锰酸钾中加入冰醋酸自身发生氧化还原反应生成二氧化锰、高锰酸钾和醋酸钾,操作Ⅰ是溶解过滤得到滤渣为二氧化锰,操作Ⅱ是滤液2通过加热浓缩、降温结晶、过滤洗涤得到高锰酸钾粗晶体,所含杂质主要为KCl、CH3COOK等,将高锰酸钾粗晶体溶于水,通过重结晶的方法可以提纯高锰酸钾晶体,用硝酸银溶液可以检验杂质是否除去,
(1)软锰矿中的二氧化锰和加入氯酸钾和氢氧化钾熔融发生氧化还原反应生成锰酸钾、氯化钾和水,结合原子守恒和电子守恒配平书写化学方程式,锰元素化合价+4价变化为+6价电子转移2e-,氯酸钾中氯元素+5价变化为-1价,电子转移6e-,电子转移总数6e-,则反应的化学方程式为:3MnO2+KClO3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O,
故答案为:3MnO2+KClO3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;
(2)K2MnO4溶液中加入冰醋酸发生反应是自身氧化还原反应生成高锰酸钾和二氧化锰,结合电子守恒、电荷守恒和原子守恒书写离子方程式,锰元素+6价变化为+7价和+4价,电子转移总数2e-,配平得到离子方程式为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-,
故答案为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-;
(3)操作Ⅱ是溶液中得到溶质固体,依据表中溶解度分析可知,溶解度随温度变化较大,可以用冷却热饱和溶液的方法得到,操作2为滤液2通过蒸发浓缩、冷却结晶、过滤洗涤得到高锰酸钾粗晶体,
故答案为:蒸发浓缩、冷却结晶、过滤;
(4)参加反应过程最后又生成的物质可以循环使用,上述分析可知二氧化锰参与反应又生成可以循环使用,
故答案为:MnO2;
(5)高锰酸钾粗晶体,所含杂质主要为KCl、CH3COOK等,将高锰酸钾粗晶体溶于水,通过重结晶的方法可以提纯高锰酸钾晶体,用硝酸银溶液可以检验杂质是否除去,所以操作3用到的试剂为蒸馏水和硝酸银溶液,若用硫酸代替图中的冰醋酸,生成的硫酸钾溶解度小易在晶体中含有更多杂质,硫酸酸性太强,导致MnO4-将Cl-氧化,产生有毒的Cl2,KMnO4损失且纯度降低,
故答案为:KCl;CH3COOK;蒸馏水;硝酸银溶液;反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低或硫酸酸性太强,导致MnO4-将Cl-氧化,产生有毒的Cl2,KMnO4损失且纯度降低.
点评 本题考查了物质提纯和分离的生产过程分析,主要是氧化还原反应产物的理解应用,注意化学方程式、离子方程式书写,转化关系中的实验操作和分离方法是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
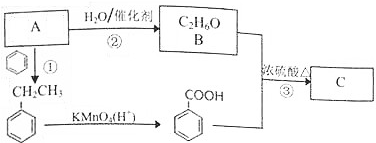
 +CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
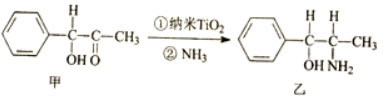
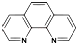 ),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.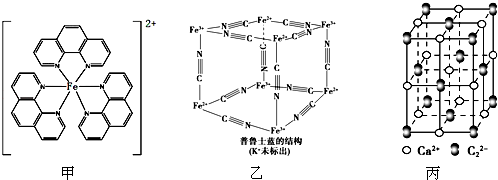
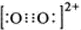 ,其中σ键与π键数目之比为1:2.
,其中σ键与π键数目之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲的球棍模型 | 乙的结构式 | 丙的球棍模型 | 丁的比例模型 |
 |  | 丙的分子式为C13H10O3 | 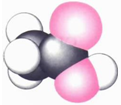 |
| A. | 甲可代表氨基酸 | B. | 乙的二氯代物有3种 | ||
| C. | 丙的结构简式为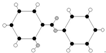 | D. | 丁可代表乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
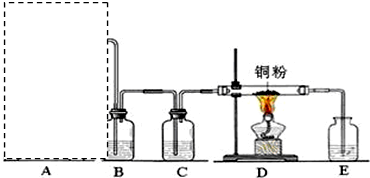
 实验室用如图所示装置制取溴化亚铁.D和d中均盛有液溴,E为外套电炉丝的瓷管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将干燥、纯净的CO2气流通入D中,然后将铁粉加热至600℃~700℃,E管中反应开始.E中的反应为:2Fe+3Br2═2FeBr3,2FeBr3$\frac{\underline{\;\;△\;\;}}{\;}$2FeBr2+Br2↑,最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.请回答:
实验室用如图所示装置制取溴化亚铁.D和d中均盛有液溴,E为外套电炉丝的瓷管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将干燥、纯净的CO2气流通入D中,然后将铁粉加热至600℃~700℃,E管中反应开始.E中的反应为:2Fe+3Br2═2FeBr3,2FeBr3$\frac{\underline{\;\;△\;\;}}{\;}$2FeBr2+Br2↑,最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.请回答:| 实验操作 | 实验现象 | 氧化性强弱 |
| ① | 溶液呈血红色 | ② |
| ③ | ④ | Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(l);△H=-142.9 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=-285.8 kJ•mol-1 | |
| C. | 2H2+O2=2H2O;△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-285.8 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com