
如图所示,烧杯中装有稀硫酸,A、B、C、D分别为铜、锌、碳棒、碳棒,下列说法正确的是( )
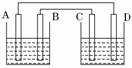
A.A、D棒上均产生气泡
B.B、C棒上均产生气泡
C.电子流动方向A→D
D.左边烧杯中溶液的pH会降低
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。
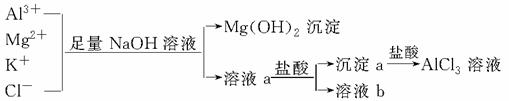
下列说法正确的是
A.NaOH溶液可以用氨水来代替
B.溶液a中含有Al3+、K+、Cl-、Na+、OH-
C.溶液b中只含有NaCl
D.向溶液a中滴加盐酸需控制溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下:

(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:________________________________________________________________________。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________(填序号)。
A.铜粉 B.氨水
C.氢氧化铜 D.碱式碳酸铜
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=_____________________________________,
此时________Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70 mL混合,反应的离子方程式为__________________________________________________________________。
(5)在0.1 L的混合酸溶液中,c(HNO3)=2 mol·L-1,c(H2SO4)=3 mol·L-1,将0.3 mol的铜放入加热充分反应后,被还原的HNO3的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
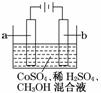 电化学原理广泛用于工业生产中,如有一种电化学净水法的原理是:在电解过程中将低价金属离子(如Co2+)氧化成高价态的离子(Co3+),然后以此高价态的金属离子作氧化剂把废水中的有机物氧化成CO2而净化。实验室用如图装置模拟上述过程,下列说法正确的是
电化学原理广泛用于工业生产中,如有一种电化学净水法的原理是:在电解过程中将低价金属离子(如Co2+)氧化成高价态的离子(Co3+),然后以此高价态的金属离子作氧化剂把废水中的有机物氧化成CO2而净化。实验室用如图装置模拟上述过程,下列说法正确的是
( )
A.电极a可以是石 墨,电极b可以是铜
墨,电极b可以是铜
B.电解后阴极附近H+浓度不变
C.Co3+氧化甲醇的离子方程式为:6Co3++CH3OH+H2O===CO2↑+6Co2++6H+
D.当1 mol 甲醇被完全氧化时,阳极应该失去4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
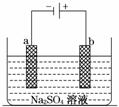 如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是( )
如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是( )
A.逸出气体的体积: a电极的大于b电极的
a电极的大于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产硫酸时,其中一步反应是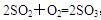 ,下列说法错误的是( )
,下列说法错误的是( )
A、增大氧气的浓度可提高反应速率
B、升高温度可提高反应速率
C、使用催化剂能显著增大反应速率
D、达到化学平衡时正逆反应速率相等且都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是化学研究的重要方法,下列各组物质的分类正确的是 ( )
A.同位素:D2、H2、T2
B.含极性键、由分子构成的化合物:CO2、CCl4、NH3
C.非电解质:NH3、C2H5OH、Cl2
D.同系物:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com