
分析 (1)具有相同核电荷数即质子数的同一类原子的总称叫元素;具有一定数目质子和一定数目中子的一种原子叫做核素,具有相同质子数,不同的中子数的核素互称同位素,对于原子AZX来说,中子数(N)=质量数(Z)-质子数(A);
(2)①根据同一主族元素的最外层电子数相等;
②第3周期的最高化合价从左→右依次升高;
③碱金属属于金属晶体,半径越大,金属键越弱;
(3)阴离子的中子数为N:AXn-共有x个电子,根据中子数(N)=质量数(Z)-质子数(A);
(4)电解质:在水溶液中或熔融状态下能够导电的化合物,由此分析解答.
解答 解:(1)原子::${\;}_{6}^{12}$C、147N、${\;}_{11}^{23}$Na、${\;}_{1}^{3}$H、${\;}_{92}^{235}$U、${\;}_{19}^{40}$K、${\;}_{92}^{238}$U质子数都92,属于同一元素,所以共有6种元素,具有一定数目质子和一定数目中子的一种原子叫做核素,所以共有7种核素,原子AZX,中子数(N)=质量数(Z)-质子数(A),${\;}_{92}^{235}$U、${\;}_{92}^{238}$U质子数都92,中子数不同,属于同位素,
故答案为:6、7、${\;}_{92}^{235}$U、${\;}_{92}^{238}$U;(1)6、7、${\;}_{92}^{235}$U、${\;}_{92}^{238}$U
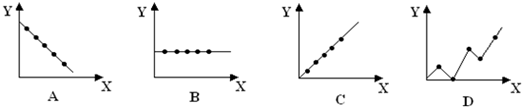
(2)①ⅡA族元素的最外层电子数相等,图象B符合,
故答案为:B;
②第3周期的最高化合价从左→右依次升高,图象C符合,
故答案为:C;
③因碱金属属于金属晶体,半径越大,金属键越弱,熔沸点越低,则碱金属单质的熔点随原子序数的增大而降低,图象A符合,
故答案为:A.(2)、①B、②C、③A
(3)阴离子的中子数为N:AXn-共有x个电子,所以质子数为:x-n,根据中子数(N)=质量数(Z)-质子数(A)=A-x+n,故答案为:A-x+n;
A-x+n
(4)NH3是非电解质;Na2O是电解质;CO2是非电解质;CaCl2是电解质;CCl4是非电解质;N2是单质;NaHCO3是电解质;NaOH是电解质;Na2O2是电解质;NH4Cl是电解质;所以属于电解质的有6个,故答案为:6个.
点评 本题考查原子的构成、化学键、元素周期律等知识,比较基础,侧重对基础知识的巩固.注意物质中存在的化学键,注意一种不同的原子就是一种核素,题目难度不大.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol/L 盐酸 | pH=3 盐酸 | 0.1mol/L 氨水 | pH=11 氨水 |
| A. | 由水电离出的c(H+):①>③ | |
| B. | ③稀释到原来的100倍后,pH与④相同 | |
| C. | ①与③混合,若溶液pH=7,则V(盐酸)>V(氨水) | |
| D. | ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
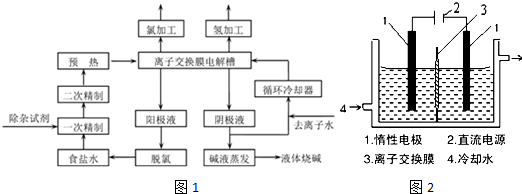
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定有乙炔 | D. | 一定有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中提取溴、碘都涉及置换反应,从矿物质中获取铝、铁、铜、硅都不涉及置换反应 | |
| B. | 利用溶解度数据可推测将一些混合物质分离开来的可能性,利用原子半径数据可推测某些原子的氧化性和还原性的强弱 | |
| C. | 因为食盐能使细菌变性,所以可以用食盐水杀死H7N9禽流感病毒 | |
| D. | 某反应的△H>0、△S<0,则该反应一定不能正向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

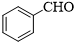 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种溶液pH的大小顺序:①>④>③>② | |
| B. | ①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3•H2O) | |
| C. | ①、②中分别加入25mL0.1mol•L-1盐酸后,溶液中c(NH4+):①>② | |
| D. | ③、④中分别加入12.5mL0.1mol•L-1NaOH溶液后,两溶液中离子种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 5 | B. | 3 | C. | 2 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com