
| A. | c(H+ )=1.0×10-13mol/L溶液:C6H5O-、K+、SO42-、Br- | |
| B. | 能使紫色石蕊变红的溶液中:NO3-、I-、Ba2+、AlO2- | |
| C. | pH=2的溶液中:Na+、S2-、HCO3-、Ca2+ | |
| D. | 能与金属铝反应放出氢气的溶液:K+ NO3- SO42- NH4+ |
分析 A.c(H+ )=1.0×10-13mol/L溶液,显碱性;
B.能使紫色石蕊变红的溶液,显酸性;
C.pH=2的溶液,显酸性,不能存在弱酸根离子;
D.能与金属铝反应放出氢气的溶液,为非氧化性酸或强碱溶液.
解答 解:A.c(H+ )=1.0×10-13mol/L溶液,显碱性,该组离子之间不反应,可大量共存,故A正确;
B.能使紫色石蕊变红的溶液,显酸性,NO3-、I-、H+发生氧化还原反应,且酸性溶液中不能大量存在AlO2-,故B错误;
C.pH=2的溶液,显酸性,S2-、HCO3-不能大量存在,故C错误;
D.能与金属铝反应放出氢气的溶液,为非氧化性酸或强碱溶液,酸溶液中NO3-、Al、H+发生氧化还原反应不生成氢气,碱溶液中不能大量存在NH4+,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
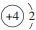 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
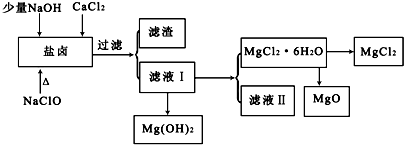
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
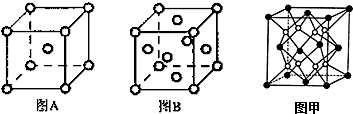 X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示): ,其基态原子有26种运动状态不同的电子;
,其基态原子有26种运动状态不同的电子;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NH4++H2O═NH3•H2O+H+ | D. | BaSO4(s)?Ba2+(aq)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
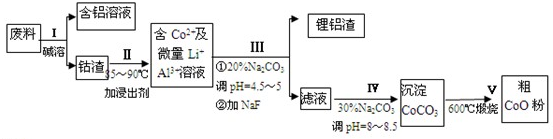
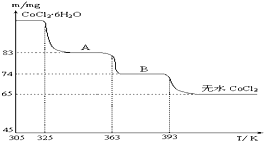
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L CO2中含有原子数为0.3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-为0.1NA | |
| C. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1NA | |
| D. | 1L0.1molL-1的氨水中有NA个NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
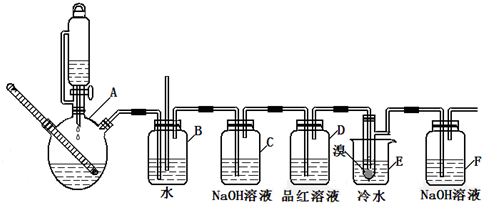
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com