
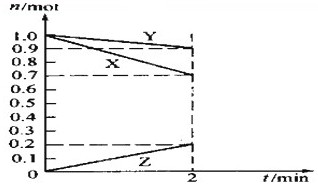
 (1)反应A+3B=2C+2D在四种不同情况下的反应速率分别为
(1)反应A+3B=2C+2D在四种不同情况下的反应速率分别为| △c |
| △t |
 2Z;
2Z;| △c |
| △t |
| ||
| 2min |
 2Z;0.05mol?(L?min)-1.
2Z;0.05mol?(L?min)-1.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
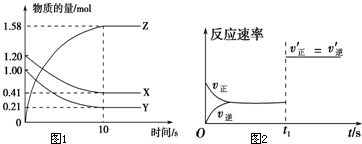 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图1所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
1 1 |
2 1 |
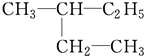 和
和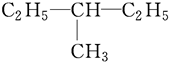
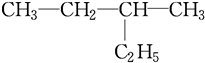 和
和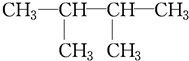
查看答案和解析>>
科目:高中化学 来源: 题型:
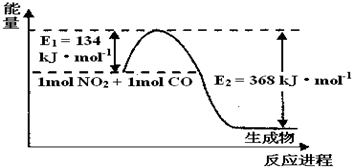
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
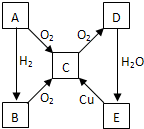 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 四 | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
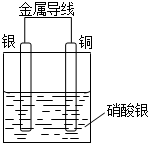 某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com