
下列图中的实验方案,能达到实验目的是()
A B C D
实验
方案 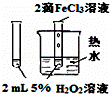
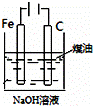

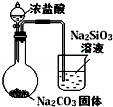
实验
目的 验证FeCl3对H2O2分解反应有催化作用 制备Fe(OH)2并能较长时间观察其颜色 除去CO2气体中混有的SO2 比较HCl、H2CO3和H2SiO3的酸性强弱
A. A B. B C. C D. D
考点: 化学实验方案的评价.
专题: 实验评价题.
分析: A.应在温度相同的条件下进行对比实验;
B.煤油能抑制亚铁离子被氧化;
C.CO2和SO2都可与碳酸钠溶液反应;
D.盐酸易挥发,不能排除盐酸的干扰.
解答: 解:A.温度和催化剂都可影响反应速率,比较催化剂的影响,应在温度相同的条件下进行对比实验,故A错误;
B.煤油阻止了亚铁离子和氧气接触,从而阻挡了亚铁离子被氧化,所以能实现实验目的,故B正确;
C.CO2和SO2都可与碳酸钠溶液反应,应用饱和碳酸氢钠除杂,故C错误;
D.盐酸易挥发,不能排除盐酸的干扰,应先通过饱和碳酸氢钠除去二氧化碳中的氯化氢,故D错误.
故选B.
点评: 本题考查较为综合,涉及物质的性质对比、除杂等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为2015届高考常见题型和高频考点,注意把握实验的原理和实验操作的严密性和可行性的评价,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
如图:利用Fe+CuSO4=FeSO4+Cu反应设计一个原电池.下列说法中,正确的是( )
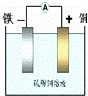
|
| A. | 电解质溶液中阳离子向负极移动 |
|
| B. | 电子通过溶液由负极流向正极 |
|
| C. | 当导线中有1mol电子通过时,理论上正极消耗28克. |
|
| D. | 若所选电极的质量相等,理论上两极质量差为60g,导线中有1mol电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:
矿泉水是人们居家旅游常用的饮料,市场上有些不法商贩为牟取暴利,用自来水(用氯气消毒)冒充矿泉水出售.为辨别真伪,可用下列的一种化学试剂来鉴别,该试剂是( )
A. 酚酞试液 B. 氯化钡溶液 C. 氢氧化钠溶液 D. 硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)等质量的O2、CH4、H2的物质的量的比值为 .
38g某二价金属氯化物(ACl2)中含有0.8mol Cl﹣,则ACl2的摩尔质量是 ;A的相对原子质量是 ;ACl2的化学式是 .
(3)新制备的氯水显 色,说明氯水中有 (填分子式)分子存在.
(4)向氯水中滴加几滴AgNO3溶液,立即有 生成,说明氯水中有 (填离子符号)存在,反应的化学方程式为 氯水光照后颜色变浅,并放出 气体.
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害.
Ⅰ. 氨气是一种重要的化工原料.
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:
CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:则A点的逆反应速率V(逆)(CO2)<B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是 .
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s)⇌2NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为26.该反应的化学平衡常数的表达式为K= .
Ⅱ.氮的氧化物会污染环境.
(3)采取还原法,用炭粉可将氮的氧化物还原.
已知:N2(g)+O2(g)=2NO(g)△H=+180.6kJ•mol﹣1, C(s)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1
写出炭粉还原一氧化氮的热化学反应方程式
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为 .若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为 .

查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应4NH3(g)+5O2(g)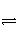
 4NO(g)+6H2O(g),下列叙述正确的是( ) A.达到化学平衡时,4v正(O2)=5v逆(NO)
4NO(g)+6H2O(g),下列叙述正确的是( ) A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成xmolNO的同时消耗xmolNH3,则反应达到平衡状态
C.化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A(g)+B(g)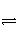
 2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。
2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。

①由T1向T2变化时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
②由T3向T4变化时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
③反应在________温度下达到平衡。
④此反应的正反应为______热反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.合成氨反应中,断开1 mol N≡N键,就会同时生成6 molN—H键,此时达化学平衡状态
B.有气体参与的可逆反应中,当反应容器中的压强保持不变时,即达到化学平衡状态
C.当反应物或生成物在混合物中的百分含量保持不变时,即达到化学平衡状态
D.工业生产中采用高温是因为高温下反应物的转化率比低温时高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com