
(1) ��4�֣��ڴ��л������ܱ������з�����Ӧ��Fe2O3��3H2===2Fe��3H2O����ȡ���д�ʩ���ܸı䷴Ӧ���ʵ���(����)
A������Fe2O3��Ͷ����
B������������������䣬����H2��������
C������N2������������ѹǿ����
D������N2�����������������
��8�֣����ݻ�Ϊ10 L���ܱ�������ͨ��40 mol N2��120 mol H2����һ�������½��з�Ӧ����2 s��ﵽƽ��״̬��ƽ��ʱc(N2)Ϊ2 mol/L��
(2)��H2��Ũ�ȱ仯��ʾ2 s�ڵ�ƽ������v(H2)��________��
(3)������ת������________��
(4)ƽ��ʱ��������а������������________��
(5)�����ڷ�Ӧǰ��ѹǿ����________��
(1)AD(12�֣�ÿ��2�֣���2��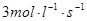 (3) 50% (4)33.3%
(5)4:3
(3) 50% (4)33.3%
(5)4:3
����������1�������Һ���������ı䷴Ӧ���ʣ����⣬��������ͨ������ʱ��ֻ��Ӱ���˷�Ӧ������Ũ��ʱ�Ż�Ӱ�췴Ӧ���ʡ�������D���ݻ�������䣬��Ȼ���뵪��������Ӧ������������Ũ�Ȳ�û�иı䣬���Է�Ӧ���ʲ�����ı䣻C���ڱ���ѹǿ���������£�ͨ������������Ӧ����������Ũ�Ⱦ���С����Ӧ���ʼ�С��
��2�� N2 �� 3H2 2NH3
2NH3
��n: 40 120 0
��n: 20 60 40
ƽn: 20 60 40


 ��ʦ������Ԫ��ĩ���100��ϵ�д�
��ʦ������Ԫ��ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��101��Уͬ����ϰ���߶���ѧ��ɽ����ѧ���������� ³�̰� ���ͣ�021
|
�ڴ��л������ܱ������м���5 molH2��5 molN2����ij�¶��·�Ӧ����2 molNH3������ʱ������ѹǿ���䣬������������Ƿ�Ӧǰ�� | |
A�� |
2�� |
B�� |
1.5�� |
C�� |
0.8�� |
D�� |
0.5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꼪��ʡ����һ�и�һ��ѧ�����п��Ի�ѧ�Ծ����������� ���ͣ������
(1) ��4�֣��ڴ��л������ܱ������з�����Ӧ��Fe2O3��3H2===2Fe��3H2O����ȡ���д�ʩ���ܸı䷴Ӧ���ʵ���(����)
| A������Fe2O3��Ͷ���� |
| B������������������䣬����H2�������� |
| C������N2������������ѹǿ���� |
| D������N2����������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��³�ư���л�ѧѡ��4 2.4��ѧ��Ӧ�������Ż�-��ҵ��ϰ���������棩 ���ͣ�ѡ����
�ڴ��л������ܱ������м���5molH2��5molN2����ij�¶��·�Ӧ����2molNH3������ʱ������ѹǿ���䣬������������Ƿ�Ӧǰ�ģ���������
A��2�� B��1.5�� C��0.8�� D��0.5��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com