
已知H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6kJ/mol,则反应HCl(g)═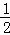 H2(g)+
H2(g)+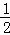 Cl2(g)的△H为( )
Cl2(g)的△H为( )
|
| A. | +184.6kJ/mol | B. | ﹣92.3kJ/mol | C. | ﹣369.2kJ/mol | D. | +92.3kJ/mol |
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
|
| A. | 常温常压下,1mol C2H4所含的电子数为12NA |
|
| B. | 标准状况下,16g甲烷中共价键数目为4NA |
|
| C. | 常温常压,4 g氦气所含的核外电子数为4NA |
|
| D. | 16g氧气和臭氧的混合物中含有1.5NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32﹣)、c(HCO3﹣)都减少,其方法是( )
|
| A. | 通入二氧化碳气体 | B. | 加入氢氧化钠固体 |
|
| C. | 通入氯化氢气体 | D. | 加入饱和石灰水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有8 g Na2O2、Na2O、Na2CO3、NaOH的混合物与200 g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为 ( )
A.8 g B.15.5 g C.11.7 g D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
|
| A. | 电池工作时,锌失去电子 |
|
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e﹣═Mn2O3(s)+2OH﹣(aq) |
|
| C. | 电池工作时,电子由正极通过外电路流向负极 |
|
| D. | 外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
|
| A. | 加热 |
|
| B. | 不用稀硫酸,改用98%的浓硫酸 |
|
| C. | 滴加少量CuSO4溶液 |
|
| D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
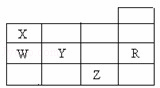
|
| A. | 常压下五种元素的单质中,Z单质的沸点最高 |
|
| B. | Y、Z的阴离子电子层结构都与R原子的相同 |
|
| C. | W的氢化物的沸点比X的氢化物的沸点高 |
|
| D. | Y元素的非金属性比W元素的非金属性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com