
| A. | 61 | B. | 27 | C. | 88 | D. | 34 |
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
 人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为:
人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
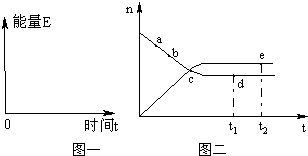
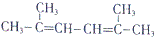 .
.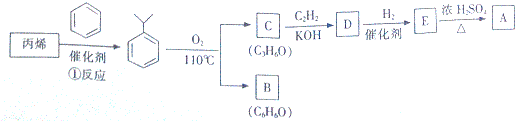
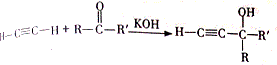
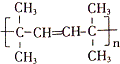 ,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.
,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.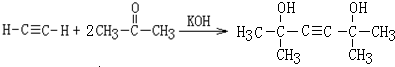 .
.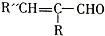 +H2O
+H2O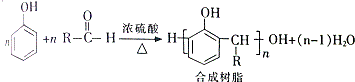
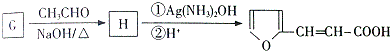
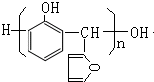 .
.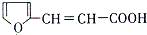 的所有同分异构体的结构简式
的所有同分异构体的结构简式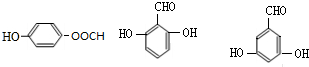 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
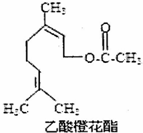
| A. | 该有机物分子式为C12H20O2 | |
| B. | 能发生加成反应和取代反应 | |
| C. | 不能使酸性KMnO4溶液褪色 | |
| D. | 1mol该有机物最多能与2mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
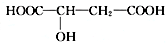 .请回答:
.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
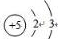 ,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
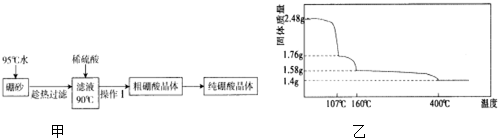
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭去除汽车内室的异味 | |
| B. | 用硝酸对钢船舱进行钝化处理 | |
| C. | 用经硫酸酸化处理的三氧化铬硅胶检验酒精 | |
| D. | 用小苏打溶水拌入面中一起蒸煮使馒头蓬松 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com