
| A£® | 0.1mol•L-1ijŅ»ŌŖČõĖį£ØHA£©ČÜŅŗÖŠ£ŗc2£ØH+£©=c£ØH+£©•c£ØA-£©+Kw | |
| B£® | ŅŃÖŖKa£ØHNO2£©=4.6”Į10-4£¬Kb£ØNH3•H2O£©=1.8”Į10-5£¬æÉĶʶĻNH4NO3ČÜŅŗ³Ź¼īŠŌ | |
| C£® | 25”ꏱ£¬ĻÖĻņ10mLÅضČĪŖ0.1mol•L-1µÄCH3COOHČÜŅŗÖŠµĪ¼ÓĻąĶ¬ÅØ¶ČµÄ°±Ė®£¬ŌŚµĪ¼Ó¹ż³ĢÖŠ$\frac{c£ØN{{H}_{4}}^{+}£©}{c£ØN{H}_{3}•{H}_{2}O£©}$ĻČŌö“óŗó¼õŠ” | |
| D£® | NH4ClČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗÖĮČÜŅŗ³ŹÖŠŠŌŹ±£¬ŌņÓŠc£ØNa+£©£¾c£ØNH3•H2O£© |
·ÖĪö A”¢øł¾ŻµēŗÉŹŲŗćæÉÖŖ£ŗc£ØH+£©=c£ØA-£©+c£ØOH-£©£¬×óÓŅĮ½±ßĶ¬³ĖĒāĄė×ÓµÄÅØ¶Č¼“æɵƵ½£»
B”¢Ō½ČõŌ½Ė®½ā£¬Ė®½ā³Ģ¶ČŌ½“ó£»
C”¢øł¾ŻŅ»Ė®ŗĻ°±µÄµēĄėĘ½ŗā³£ŹżæÉÖŖ£¬øƱČÖµÓėĒāŃõøłĄė×ӳɷ“±Č£¬µē½ā°±Ė®µÄ¹ż³ĢÖŠ£¬ČÜŅŗÖŠĒāŃõøłĄė×ÓÅضČÖš½„Ōö“ó£»
D”¢NH4ClČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗÖĮČÜŅŗ³ŹÖŠŠŌŹ±£¬øł¾ŻµēŗÉŹŲŗć£ŗc£ØNa+£©+c£ØH+£©+c£ØNH4+£©=c£ØOH-£©+c£ØCl-£©£¬ČÜŅŗ³ŹÖŠŠŌ£¬ĖłŅŌc£ØNa+£©+c£ØNH4+£©=c£ØCl-£©¢Ł£¬ÓÉĪļĮĻŹŲŗćc£ØCl-£©=c£ØNH4+£©+c£ØNH3•H2O£©¢Ś£¬ÓÉ¢Ś“śČė¢ŁæÉÖŖ£®
½ā“š ½ā£ŗA”¢øł¾ŻµēŗÉŹŲŗćæÉÖŖ£ŗc£ØH+£©=c£ØA-£©+c£ØOH-£©£¬×óÓŅĮ½±ßĶ¬³ĖĒāĄė×ÓµÄÅØ¶Č£¬µĆ£ŗc2£ØH+£©=c£ØH+£©•c£ØA-£©+Kw£¬¹ŹAÕżČ·£»
B”¢Ō½ČõŌ½Ė®½ā£¬Ė®½ā³Ģ¶ČŌ½“󣬶ųNH4NO3ŹĒĒæĖįČõ¼īŃĪ£¬ČÜŅŗĖ®½ā³ŹĖįŠŌ£¬¹ŹB“ķĪó£»
C”¢µ±ĻņCH3COOHČÜŅŗÖŠµĪ¼ÓĻąĶ¬ÅØ¶ČµÄ°±Ė®£¬æŖŹ¼Ź±ČÜŅŗĪŖCH3COOHŗĶCH3COONH4µÄ»ģŗĻĪļ£¬ÓÉCH3COONH4µÄĖ®½ā³£ŹżKh=$\frac{c£Ø{H}^{+}£©•c£ØN{H}_{3}•{H}_{2}O£©}{c£ØN{H}_{4}^{+}£©}$£¬Ėę×Å°±Ė®µÄ¼ÓČė£¬c£ØH+£©Öš½„¼õŠ”£¬Kh²»±ä£¬Ōņ$\frac{c£ØN{{H}_{4}}^{+}£©}{c£ØN{H}_{3}•{H}_{2}O£©}$Ļȱ䊔£¬µ±¼Ó°±Ė®ÖĮČÜŅŗĻŌ¼īŠŌŹ±£¬°±Ė®µÄµēĄė³£ŹżKb=$\frac{c£ØO{H}^{-}£©•c£ØN{H}_{4}^{+}£©}{c£ØN{H}_{3}•{H}_{2}O£©}$£¬c£ØOH-£©ÓėĒāĄė×ÓÅØ¶Č³É·“±Č£¬Ėę×Å°±Ė®µÄµĪČė£¬ĒāŃõøłĄė×ÓÅضČÖš½„Ōö“󣬵ēĄė³£ŹżK²»±ä£¬ĖłŅŌ$\frac{c£ØN{{H}_{4}}^{+}£©}{c£ØN{H}_{3}•{H}_{2}O£©}$Öš½„¼õŠ”£¬¼“$\frac{c£ØN{{H}_{4}}^{+}£©}{c£ØN{H}_{3}•{H}_{2}O£©}$Ź¼ÖÕ¼õŠ”£¬¹ŹC“ķĪó£»
D”¢NH4ClČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗÖĮČÜŅŗ³ŹÖŠŠŌŹ±£¬øł¾ŻµēŗÉŹŲŗć£ŗc£ØNa+£©+c£ØH+£©+c£ØNH4+£©=c£ØOH-£©+c£ØCl-£©£¬ČÜŅŗ³ŹÖŠŠŌ£¬ĖłŅŌc£ØNa+£©+c£ØNH4+£©=c£ØCl-£©¢Ł£¬ÓÉĪļĮĻŹŲŗćc£ØCl-£©=c£ØNH4+£©+c£ØNH3•H2O£©¢Ś£¬ÓÉ¢Ś“śČė¢ŁæÉÖŖ£¬c£ØNa+£©=c£ØNH3•H2O£©£¬¹ŹD“ķĪó£»
¹ŹŃ”A£®
µćĘĄ ±¾Ģāæ¼²éĮĖĖį¼ī»ģŗĻŹ±ČÜŅŗ¶ØŠŌÅŠ¶Ļ¼°ČÜŅŗĖį¼īŠŌÓėČÜŅŗpHµÄ¹ŲĻµ£¬ĢāÄæÄѶČÖŠµČ£¬×¢ŅāÕĘĪÕČÜŅŗĖį¼īŠŌÓėČÜŅŗpHµÄ¹ŲĻµ£¬Ć÷Č·øł¾ŻµēŗÉŹŲŗć”¢ĪļĮĻŹŲŗć”¢ŃĪµÄĖ®½ā±Č½ĻČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”µÄ·½·Ø£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
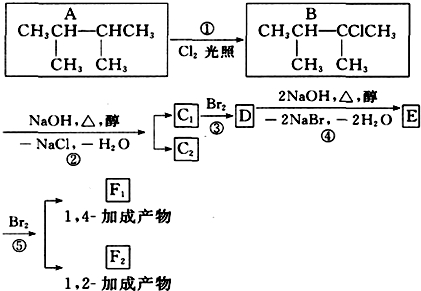
 £®
£® £»F 1µÄ½į¹¹¼ņŹ½ŹĒ
£»F 1µÄ½į¹¹¼ņŹ½ŹĒ £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
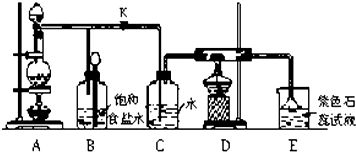
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
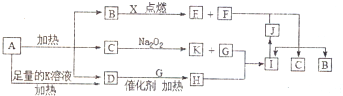
 £¬Š“³öFµÄŅ»ÖÖĶ¬ĖŲŅģŠĪĢ彚øÕŹÆ£ØC60”¢ŹÆÄ«µČ£©£¬D·Ö×ÓµÄæռ乹ŠĶĪŖČż½Ē׶ŠĪ£®
£¬Š“³öFµÄŅ»ÖÖĶ¬ĖŲŅģŠĪĢ彚øÕŹÆ£ØC60”¢ŹÆÄ«µČ£©£¬D·Ö×ÓµÄæռ乹ŠĶĪŖČż½Ē׶ŠĪ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | c£ØOH-£©=2.0”Į10-7mol•L-1 | B£® | Kw=1”Į10-14 | ||
| C£® | c£ØOH-£©=1.0”Į10-14/2.0”Į10-7mol•L-1 | D£® | ĪĀ¶ČĪŖ25”ę |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
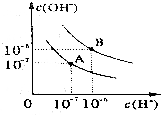 ŅŃÖŖĖ®ŌŚ25”ęŗĶ95”ꏱ£¬ĘäµēĄėĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾£ŗ
ŅŃÖŖĖ®ŌŚ25”ęŗĶ95”ꏱ£¬ĘäµēĄėĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 40”ꏱ£¬0.005mol/LH2SO4ČÜŅŗµÄpHĪŖ2 | |
| B£® | ĶłĀČ»ÆĢśČÜŅŗÖŠµĪ¼Ó°±Ė®Ą“ÖʱøĒāŃõ»ÆĢś½ŗĢå | |
| C£® | ¶ĘŠæĢśÖĘĘ·¶Ę²ćŹÜĖšŗó£¬ĢśÖĘĘ·Ņ×ÉśŠā | |
| D£® | ŅŃÖŖNaOHČÜŅŗŗĶCH3COONH4ČÜŅŗ¾łĻŌŹ¾ÖŠŠŌ£¬ŌņĮ½ČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶ČĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŅŅĻ©”¢±½”¢»·¼ŗĶéŹōÓŚÖ¬·¾Ģž | B£® | ±½”¢»·¼ŗĶéŹōÓŚ·¼ĻćĢž | ||
| C£® | ŅŅĻ©”¢ŅŅČ²ŹōÓŚĻ©Ģž | D£® | »·ĪģĶ锢»·¼ŗĶéŹōÓŚ»·ĶéĢž |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com