
������������˫��ˮ��ҽ������������ɱ��������������ϴ�˿ڡ��ش������й�˫��ˮ��һЩ���⣺
��1��������Ӧ�У�H2O2�����������Եķ�Ӧ�ǣ�����ţ���ͬ��
A��Na2O2+2HCl=2NaCl+H2O2
B��Ag2O+H2O2=2Ag+O2��+H2O
C��2H2O2=2H2O+O2��
D��3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
��2��������������Լ�ƿ�ϵ����ʺ����ϵ�һ����ǩ�� ������ĸ���ţ���
��3��ijǿ�ᷴӦ��ϵ�з�����һ��������ԭ�����ӷ�Ӧ����Ӧ��������ﹲ��������
O2��MnO4-��H2O��Mn2+��H2O2��H+����֪�÷�Ӧ��H2O2ֻ���������¹��̣�H2O2��O2��
��д���÷�Ӧ�����ӷ���ʽ����ƽ_______________________________��
�����������Ӧ����6.72L����״�����������ɣ�ת�Ƶĵ�����ĿΪ ��
��4��H2O2��ʱ����Ϊ��ҵ��Һ���������С���ɫ�������������ƣ��������ɿ�ҵ��Һ�е��軯���KCN���������·�Ӧ��KCN+H2O2+H2O=A+NH3������ָ��������A�Ļ�ѧʽΪ ��������H2O2����Ϊ��ɫ�������������� ��
 ��ѧ����ϵ�д�
��ѧ����ϵ�д� �ο�������ϵ�д�
�ο�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꼪��ʡ��һ����ĩ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
���ݷ�Ӧʽ����1��2Fe3++2I��=2Fe2++I2����2��Br2+2Fe2+=2Br��+2Fe3+�����ж����ӵĻ�ԭ�Դ�ǿ������˳����
A��Br����Fe2+��I�� B��I����Fe2+��Br�� C��Br����I����Fe2+ D��Fe2+��I����Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶�����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ͬ�ļס������������У��ֱ��е����ʵ�����SO2��O2������ͬ�¶��·�����Ӧ��2SO2+O2 2SO3�����ﵽƽ�⡣��������У�����������������䣬����������ѹǿ���䣬����������SO2��ת����Ϊp%������������SO2��ת����
2SO3�����ﵽƽ�⡣��������У�����������������䣬����������ѹǿ���䣬����������SO2��ת����Ϊp%������������SO2��ת����
A������p% B������p% C��С��p% D�����ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������ʡ�߶�����ĩ��ѧ�Ծ��������棩 ���ͣ������
������ѧ֪ʶ��ա�
��1��д���˷��� ���еĹ��������� ��
���еĹ��������� ��
��2��д�����ȷ�Ӧ�Ļ�ѧ����ʽ ��
��3�������ӷ���ʽ��ʾ��ĭ����������ԭ�� ��
��4�����ݳ����ܽ�ƽ��ԭ���������ӷ���ʽ����̼�����������Ĺ��� ��
��5��д���л�������Ϊ 2��5 ��������4���һ�����Ľṹ��ʽ ��
��6�������£���pH=5�������pH=9��NaOH��Һ��һ��������Ȼ�Ϻ�������Һ��pH=6�������������������Һ��������� ��
��7������8�����ʣ���Ϊͬ���칹����� �顣
�ټ����ʮ���� �ڽ��ʯ��ʯī ��O2��O3 �ܼױ��ͱ���ϩ
���ڶ��ױ��ͼ���ױ� ��12C ��14C ��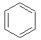 ��
��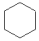 ��2-��Ȳ��1,3-����ϩ
��2-��Ȳ��1,3-����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������ʡ��һ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��100mL NaOH��Һ��ͨ��һ������CO2���壬��ַ�Ӧ������������Һ����μ���0.2mol/L�����ᣬ����CO2������������������֮���ϵ��ͼ��ʾ�������ж���ȷ����( )
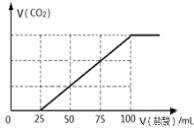
A��ԭNaOH��Һ��Ũ��Ϊ0.1mol/L
B��ͨ��CO2�����Ϊ448mL
C��������Һ�����ʳɷֵ����ʵ���֮��Ϊ(NaOH)��(Na2CO3)=1��3
D��������Һ�����ʳɷֵ����ʵ���֮��Ϊ(NaHCO3)��(Na2CO3)=2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016��������������ѧԺ������ѧ��һ����ĩ��ѧ���������棩 ���ͣ�ѡ����
ij��ɫ��Һ�з�����Ƭ�������������������������ڸ���Һ�п϶����Դ������ڵ���
A��Na+ B��Mg2+ C��HCO3- D��OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������ʡ�߶�����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��ӦaA (g)+ bB (g)  cC(g)������ƽ����ϵ��ͼ��ʾ��������˵����ȷ����( )
cC(g)������ƽ����ϵ��ͼ��ʾ��������˵����ȷ����( )
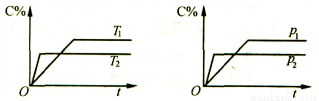
A�� Tl>T2����H<0 B�� Tl<T2����H<0 C�� Pl>P2��a+b>c D�� Pl<P2�� a+b>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ�ڵڶ����ʼ컯ѧ�Ծ��������棩 ���ͣ�ѡ����
��20mL 0��1mol/L NH4HSO4��Һ�е���0��1mol/L NaOH��Һ������˵����ȷ����
A ��������Ӧ�����У�c(H+) + c(Na+) + c(NH4+)=c(OH-) + c(SO42-)
��������Ӧ�����У�c(H+) + c(Na+) + c(NH4+)=c(OH-) + c(SO42-)
B��������30mL NaOH��Һʱ��pH��7����c(NH4+)��c(NH3��H2O)��c(OH-)��c(H+)
C��������20mL NaOH��Һʱ��2c(SO42-)=c(NH3��H2O)+ c(NH4+)
D������Һ������ʱ��c(NH4+)��c(SO42-)��c(Na+)��c(H+)= c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й��ڻ�ѧ���������������ʶ�������
A��CO2��SO2��N2�Ⱦ����������ЧӦ������
B�����ܼ��ŷ��ϵ�̼���õ�Ҫ��
C��ʹ�������Դ�Ƿ�ֹ���귢������Ҫ��ʩ֮һ
D�������������ոѻ���Ⱦ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com