
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2(g) ![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则任何酸碱中和反应的热效应均为57.3 kJ
D.已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
【答案】D
【解析】
试题分析:A、放热反应中反应物的总能量大于生成物的总能量,所以2SO2(g)和O2(g)的总能量大于2SO3(g)的总能量,故A错误;B、已知C(石墨,s)=C(金刚石,s);△H>0,反应是吸热反应,金刚石能量高于石墨,所以金刚石比石墨的键能小,故B错误;C、在稀溶液中强酸和强碱反应生成1mol水放出的热量为中和热,△H=-57.3kJ/mol,弱酸电离时吸热,所以放出的热量小于57.3kJ/mol,故C错误;D、已知2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2,一氧化碳燃烧生成二氧化碳放热,焓变是负值,所以△H1<△H2,故D正确;故选D。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验事实可用来证明氨水是弱碱的是
A. 氨水能跟氯化铝溶液反应生成氢氧化铝沉淀
B. 铵盐受热易分解
C. 1mol/L 的氨水可以使酚酞试液变红
D. 常温下0.1mol/L的氯化铵溶液的pH为5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(1)探究FeSO4溶液的酸碱性:取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和 。
A.玻璃棒 B.试管 C.天平 D.量筒
(2)利用下图装置探究FeSO4的稳定性
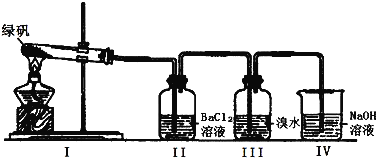
①II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是 。
A.Fe2O3 、SO3 、H2O
B.Fe2O3 、SO2 、SO3 、H2O
C.FeO 、Fe2O3 、SO2 、SO3 、H2O
②III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是 。
③NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式: 。
(3)探究FeSO4中Fe2+还原性:
证明FeSO4有较强的还原性,完成下表。
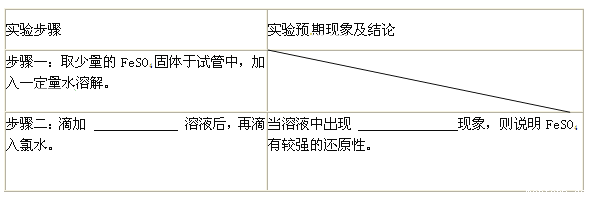
(4)硫酸亚铁用途探究
缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 设NA为阿伏伽德罗常数值。下列有关叙述不正确的是
A.将1molCl2溶入足量的水中,溶液里HClO、Cl-、ClO-粒子数之和为2NA
B.3.4g NH3中共用电子对数为0.6NA
C.相同质量的N2和CO所含有的分子数、原子总数、电子总数都相等
D.标准状况下,11.2L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 组成它们的基本元素都是C、H、O、N
B. 它们的合成过程中都有水产生
C. 它们的结构及种类都具有物种特异性
D. 它们分子的多样性是细胞多样性的根本原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原电池和电解池的叙述正确的是( )
A.原电池中失去电子的电极为正极
B.原电池的负极、电解池的阳极都发生氧化反应
C.原电池的两极一定是由活动性不同的两种金属组成
D.电解时电解池的阴极一定是阴离子放电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示
[已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1]:
2SO3(g) ΔH=-196.6 kJ·mol-1]:
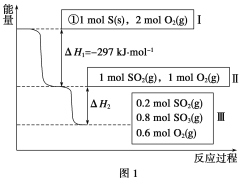
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:____________________。
(2)ΔH2=_____________________。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比|ΔH2|________(填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为__________,若溶液中发生了氧化还原反应,则该过程的离子方程式为______________________。
(5)向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2 和1 mol O2;(乙) 1 mol SO2 和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强p:p甲=p丙>2p乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中SO3的含量最高的一段时间是____________。
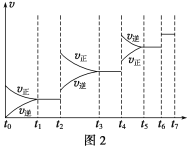
(7)各阶段平衡时对应的平衡常数如下表所示:
t1~t2 | t3~t4 | t5~t6 | t6~t7 |
K1 | K2 | K3 | K4 |
K1、K2、K3、K4之间的关系为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置检验乙烯时不需要除杂的是( )

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | C2H5OH与浓H2SO4加热至170 ℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓H2SO4加热至170 ℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com