
| 元素 | H | Li | Be | B | C | O | F |
| X的数值 | 2.20 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| X的数值 | 0.93 | 1.31 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
分析 (1)第三周期中随着原子序数的增大,X的数值依次增大;
(2)第二周期中随着原子序数的增大,半径碱性,据此解答;
(3)元素的非金属性越强,吸引电子能力越强,据此解答;
(4)根据X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键来分析;
(5)元素的金属性与非金属性越强,形成的离子化合物离子性越强.
解答 解:(1)由表格中的数据可知,金属性Na>Mg>Al,X的数值为Na<Mg<Al,则元素X的数值越大,元素的金属性越弱,故答案为:元素X的数值越大,元素的金属性越弱,即元素的非金属性越强;
(2)第二周期中随原子半径的减小,X的数值在增大,故原子半径越小,X的数值越大,故答案为:原子半径越小,X的数值越大;
(3)S的X数值为2.5,N的非金属性大于C(X的数值为2.5),则N的X数值大于S的X数值,即N的非金属性大于S的非金属性,即共用电子对偏向于N元素,故答案为:N;
(4)因表格中Al的X数值为1.61,Br的X数值为小于3.16,因Al、Br的X数值之差小于3.16-1.61=1.55<1.7,则形成共价键,故答案为:共价键;
(5)此表格中Na的金属性最强,F的非金属性最强,故NaF的离子性最强,故答案为:NaF.
点评 本题主要考查元素的性质及有机物结构测定方法,明确X的数值与非金属性的关键是解答本题的关键,较好的考查学生对表格中的数据分析整合、处理应用的能力,难度不大.


科目:高中化学 来源: 题型:填空题
 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有一个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和EO两种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
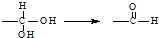 ,下列有关有机物
,下列有关有机物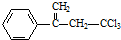 的说法不正确的是( )
的说法不正确的是( )| A. | 属于卤代烃,能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | 该物质存在顺反异构 | |
| C. | 在碱性条件下充分水解,可生成羧酸盐 | |
| D. | 1mol 该物质在一定条件下可与4molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )
则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 18和12 | B. | 6和8 | C. | 11和16 | D. | 12和9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
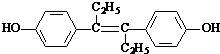
| A. | 它易溶于有机溶剂 | |
| B. | 可与NaOH和Na2CO3发生反应 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,一定有14个碳原子共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com