
| A. | 在食品袋中放入CaCl2•6H2O,可防止食物受潮 | |
| B. | “从沙滩到用户”,计算机芯片的材料是指单质硅 | |
| C. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| D. | 用Al(OH)3可以做塑料的阻燃剂,因为它受热熔化放出大量的热 |
分析 A.CaCl2•6H2O不具有吸水性;
B.依据硅为良好的半导体材料解答;
C.二氧化硫可用作葡萄酒的抗氧化剂;
D.Al(OH)3受热分解生成H2O并吸收大量的热量,使周围环境温度降低.
解答 解:A.CaCl2•6H2O不具有吸水性,不能用于食品防潮,应用无水氯化钙,故A错误;
B.沙子中含有二氧化硅,二氧化硅还原得到硅,硅可以做计算机芯片,故B正确;
C.二氧化硫具有较强的还原性,故常用作葡萄酒的抗氧化剂,故C错误;
D.Al(OH)3受热分解生成H2O并吸收大量的热量,使周围环境温度降低,且生成的氧化铝熔点较高,附着在可燃物表面,从而阻止可燃物燃烧,故D错误;
故选:B.
点评 本题综合考查物质的组成、性质与应用,为高考常见题型,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


科目:高中化学 来源: 题型:推断题
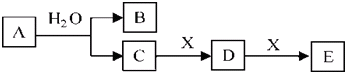
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
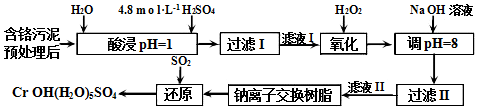
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:苯酚(
已知:苯酚(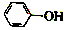 )在水中的电离方程式为
)在水中的电离方程式为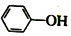 ?
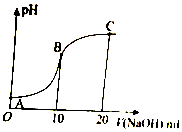
?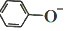 +H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )
+H+,25℃时,苯酚的电离常数Ka=1.0×10-10.25℃时,用0.0100mol•L-1的NaOH溶液滴定20.00mL0.0100mol•L-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示.下列说法正确的是( )| A. | A点溶液中,苯酚的电离度约为0.01% | |
| B. | B点溶液的pH<7 | |
| C. | C点溶液中存在c(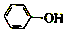 )>c(OH-)>c(H+) )>c(OH-)>c(H+) | |
| D. | A 点溶液加少量水稀释,溶液中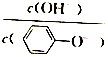 减小 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 除去NH4Cl溶液中的Fe3+ | 加入氨水至不再产生沉淀为止,然后过滤 |
| B | 检验某溶液中是否存在SO32- | 取少量溶液于试管中,滴加盐酸酸化的硝酸钡 |
| C | 证明Mg的金属性强于Al | 分別向MgCl2、AlCl3的溶液中加人足量的氨水 |
| D | 配制 100 mL0.lmol•L-1H2SO4溶液 | 用量筒量取 20 mL 0.5 mol•L-1 H2SO4 溶液沿玻璃棒注入含有80mL水的烧杯中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O的中子数为8 | B. | 16O和18O质子数相差2 | ||
| C. | 16O与18O核电荷数相等 | D. | 1个16O与1个18O质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| B. | 向醋酸溶液中加水,醋酸的电离程度增大,$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$增大 | |
| C. | 向氨水中滴加盐酸时,离子浓度大小可能是:c(NH4+)>c(OH-)>c(Cl-)>c(H+) | |
| D. | 若NaHA溶液中的pH>7,则H2A是弱酸;若NaHA溶液中的pH<7,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.7gNH4C1中含有的共用电子对数为NA | |
| B. | 0.5mol•L-1CH3COONa溶液中含有CH3COO-的数目少于0.5 NA | |
| C. | 22gN2O和22gCO2所含有的质子数均为11NA | |
| D. | 足量的镁与一定量的浓硫酸充分反应,放出2.24LSO2和H2混合气体时,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:
航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com