
���� ��1��һˮ�ϰ���������ʣ���ˮϡ�ʹٽ�����룬��ˮϡ��100������Һ��c��OH-������ԭ����$\frac{1}{100}$����2����ˮ�м����Ȼ�泥�笠�����Ũ�����������һˮ�ϰ����룻
��3�����ӻ�����ֻ���¶��йأ�����Һ����Լ�Ũ���أ��Ȼ�林ٽ�ˮ���룬笠�����ˮ�����Һ�����ԣ��Ȼ����Һ��ˮ�������c��H+��=10-pH��
��4������0.1mol NH4Cl��0.05mol NaOHȫ������ˮ�γɻ����Һ����Һ�д���NH4+��NH3•H2O����������غ�͵���غ���
��� �⣺��1��һˮ�ϰ���������ʣ���ˮϡ�ʹٽ�����룬��ˮϡ��100������Һ��c��OH-������ԭ����$\frac{1}{100}$��������25�������£���pH=11�İ�ˮϡ��100������Һ��pH����9��С��11���ʴ�Ϊ��D��
��2����ˮ�м����Ȼ�泥�笠�����Ũ�����������һˮ�ϰ����룬������Һ��c��OH-����С����Һ��pH��С���ʴ�Ϊ��C��
��3�����ӻ�����ֻ���¶��йأ�����Һ����Լ�Ũ���أ�����c��H+��•c��OH-��=10-14mol2•L-2���Ȼ�林ٽ�ˮ���룬笠�����ˮ�����Һ�����ԣ��Ȼ����Һ��ˮ�������c��H+��=10-pH=10-5mol/L��
�ʴ�Ϊ��10-14��10-5��
��4���ٸ���Nԭ���غ��֪����Һ��NH3•H2O��NH4+�������ӵ����ʵ���֮�͵���0.1mol���ʴ�Ϊ��NH3•H2O��NH4+��
�ڸ��ݵ���غ�ʽc��NH4+��+c��H+��+c��Na+��=c��OH-��+c��Cl-������c��NH4+��+c��H+��-c��OH-��=c��Cl-��-c��Na+��=0.1mol-0.05mol���ʴ�Ϊ��NH4+��H+��
���� ���⿼��������ʵ��������ˮ�⣬Ϊ��Ƶ���㣬���ؿ���ѧ����������������������Һ�����ʼ��������ǽⱾ��ؼ���ע�����غ㼰�����غ����ȷ������ã�ע�⣺���ӻ�����ֻ���¶��йأ�Ϊ�״��㣮


 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ۢ� | C�� | �ܢޢ� | D�� | �ڢޢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£���ϡ��ˮ��μ���ϡ�����У�����ҺpH=7ʱ��c��SO42-����c��NH4+�� | |
| B�� | �����£�pH=3��������ˮϡ�ͺ���ҺpH��С | |
| C�� | �����£�pH=11��NaOH��Һ��pH=3�Ĵ�����Һ�������ϣ�����ʯ����Һ�ʺ�ɫ | |
| D�� | ��0.1mol/L�İ�ˮ�м�����������粒��壬����Һ��$\frac{c��O{H}^{-}��}{c��N{H}_{3}•{H}_{2}O��}$���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �� | HF | Ka=6.8��10-4 mol•L-1 |
| �� | CH3COOH | Ka=1.7��10-5 mol•L-1 |
| �� | HCN | Ka=6.2��10-10 mol•L-1 |
| �� | H2CO3 | Ka1=4.4��10-7mol•L-1 Ka2=4.7��10-11 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 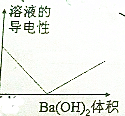 | B�� | 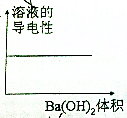 | ||
| C�� | 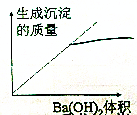 | D�� | 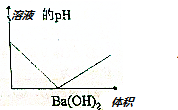 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
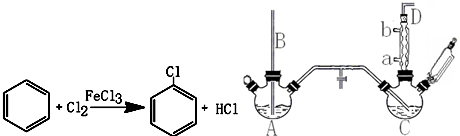
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ˮ�����ķ�Ӧ | B�� | ��Ƭ������������Һ�ķ�Ӧ | ||
| C�� | ���������������̼�ķ�Ӧ | D�� | ̼������Һ��ϡ����ķ�Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com