
| A. | ①② | B. | ⑥⑧ | C. | ②⑤ | D. | ③④⑦ |
分析 ①合金的熔点比其组成成分的熔点要低;
②生铁含有杂质碳,铁和碳在表面电解质溶液中形成原电池反应,原电池能够加快氧化还原反应速率;
③生铁含有杂质碳,铁和碳在表面电解质溶液中形成原电池反应,发生电化学腐蚀,铁做负极被腐蚀分析判断;
④根据合金的定义分析;
⑤缺铁会造成缺铁性贫血,缺钙造成人体骨质疏松;
⑥工业上采用电解熔融氧化铝的方法冶炼铝;
⑦氯化铁水解生成Fe(OH)3;
⑧电解硫酸铜溶液制取金属铜时,铜离子在阴极发生还原反应析出;
解答 解:①合金的熔点比其组成成分的熔点要低,所以纯铁的熔点比生铁高,故错误;
②与相同浓度的盐酸反应,纯铁比生铁反应速率慢,故错误;
③在潮湿空气中生铁中含有杂质和铁与表面的电解质溶液形成原电池反应,铁做负极,生铁比纯铁容易被腐蚀,故正确;
④黄铜、钢铁、硬铝都是由金属与非金属或者金属熔合而成具有金属特殊的材料,属于合金,故正确;
⑤造成人体骨质疏松的原因是缺钙,故错误;
⑥氯化铝为共价化合物不导电,工业采用电解熔融氧化铝的方法冶炼铝,故错误;
⑦氯化铁在加热条件下水解生成Fe(OH)3,故正确;
⑧电解硫酸铜溶液制取金属铜时,金属铜在阴极析出,故错误;
故选:D.
点评 本题为综合题,涉及合金的概念及性质、盐类水解的应用、原电池工作原理及金属的腐蚀与防护,题目难度中等,掌握基础是解题关键.


科目:高中化学 来源: 题型:选择题
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.099 | 0.102 | 0.143 | 0.152 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -1 | -2 | +3 | +1 |
| A. | 元素④气态氢化物的稳定性大于元素⑤气态氢化物的稳定性 | |
| B. | 元素②氢化物的沸点小于元素⑤氢化物的沸点 | |
| C. | 元素②⑥形成的化合物具有两性 | |
| D. | ⑦①可形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的有效成分是氯酸钙 | |
| B. | 将过量铁粉加入稀硝酸中,有气体生成,充分反应后滴加KSCN溶液,溶液呈血红色 | |
| C. | 将铜粉加1.0mol•L-1Fe2(SO4)3溶液中,溶液变蓝、有黑色固体出现 | |
| D. | 二氧化硅是制造光导纤维的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在0.5 mol的CO | B. | 存在0.25 mol的Na2CO3 | ||
| C. | 存在0.125 mol的O2 | D. | 存在0.75 mol的Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数位次递增.B原子的p轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的是.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子 化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体. 请根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同 | |
| B. | 白磷(P4)分子是正四面体结构,故分子中的键角为1090281 | |
| C. | CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相等 | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小为W<X<Y<Z | |
| B. | W与X、Y、Z分别形成最简单化合物中最稳定的是Z | |
| C. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .1mol乙最多可与5mol H2反应.
.1mol乙最多可与5mol H2反应.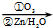 RCHO+R′CHO
RCHO+R′CHO .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com