
| R | ||
| X | Y | Z |
| A. | 原子半径大小顺序是:Y>X>R | |
| B. | 其气态氢化物的稳定性顺序是:Z>Y>X>R | |
| C. | X、Y、Z中Z的氧化物对应的水化物的酸性最强 | |
| D. | R的气态氢化物与它的含氧酸之间能发生化学反应 |
分析 若R原子核外有3个未成对电子,由短周期元素相对位置可知,R处于第二周期,X、Y、Z处于第三周期,则R原子核外电子排布为1s22s22p3,故R为N元素,可推知X为P元素、Y为S元素、Z为Cl,结合元素周期律与元素化合物性质解答.
解答 解:若R原子核外有3个未成对电子,由短周期元素相对位置可知,R处于第二周期,X、Y、Z处于第三周期,则R原子核外电子排布为1s22s22p3,故R为N元素,可推知X为P元素、Y为S元素、Z为Cl.
A.同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径X>Y>R,故A错误;
B.同主族自上而下非金属性减弱,氢化物稳定性减弱,氢化物稳定性R>X,故B错误;
C.应描述为X、Y、Z的最高价氧化物对应的水化物中Z的酸性最强,不是最高价含氧酸则不一定,如硫酸为强酸,而次氯酸为弱酸,故C错误;
D.氨气能与硝酸反应生成硝酸铵,故D正确,
故选:D.
点评 本题考查结构性质位置关系应用,侧重对元素周期律的考查,C选项为易错点,学生容易忽略“最高价”.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
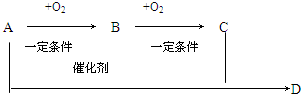 根据如图有机物的转化关系回答.已知A是乙醇.
根据如图有机物的转化关系回答.已知A是乙醇.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
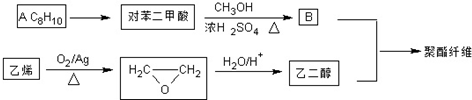
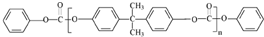
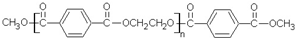 若乙二醇过量,则生成的聚酯纤维可表示为
若乙二醇过量,则生成的聚酯纤维可表示为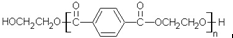 .
.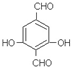 .
. 合成PC的2种单体的中:醇(或酚)的结构简式为
合成PC的2种单体的中:醇(或酚)的结构简式为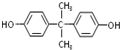 ,酯的名称为碳酸二苯酚酯.
,酯的名称为碳酸二苯酚酯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有离子键 | B. | 属于原子晶体 | ||
| C. | 既有离子键又有共价键 | D. | 属于离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
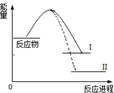
| A. | 1molN≡N键能与3molH-H键能之和大于6molN-H键能,所以反应为放热 | |
| B. | N2(g)+3H2(g)?2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1 | |
| C. | 选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少 | |
| D. | 2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
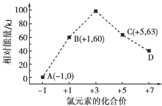 氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:| 化学式 | Cl2O | ClO2 | Cl2O7 |
| 相对分子质量 | 87 | 67.5 | 183 |
| 沸点/℃ | 2 | 9.7 | 81 |
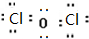 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com