
【题目】(1)关于反应H2(g)+![]() O2(g)===H2O(l),下列说法正确的是________(填字母)。
O2(g)===H2O(l),下列说法正确的是________(填字母)。
A.焓变ΔH<0,熵变ΔS<0
B.可以把反应设计成原电池,实现能量的转化
C.该反应在常温下不易被观察,因为具有较高的活化能,反应速率小
D.选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2)电渗析法淡化海水装置示意图如图所示,在电场中利用膜技术可以实现淡化海水和浓缩海水的分离。
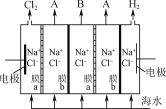
①图中膜a应选用________(填“阳离子”或“阴离子”)交换膜。
②各间隔室的排出液中,A为________(填“淡化海水”或“浓缩海水”)。
③电渗析法还可用来处理电镀废液,写出用该方法处理含AgNO3废液时所发生反应的化学反应方程式:______。
(3)水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2 ℃)、临界压强(22.1 MPa)时的水称为超临界水。
①如果超临界水的电离度变为常温下的100倍,则此时Kw的值为____。
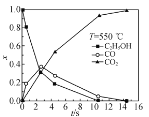
②超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图,其中x为以碳元素计的物质的量分数,如xCO=![]() ,t为反应时间。 CO的分布分数先增后降的原因是___。
,t为反应时间。 CO的分布分数先增后降的原因是___。
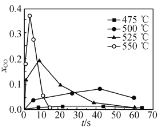
③不同温度下乙醇的超临界水氧化过程中CO的分布分数随时间变化如图所示,随着温度升高,CO分布分数峰值出现的时间提前且峰值更高的原因是________。
【答案】ABCD 阴离子 淡化海水 4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 10-10 在超临界水氧化过程中,乙醇先氧化为CO,CO再氧化为CO2(CO为反应中间产物,CO2为反应最终产物) 乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
4Ag+O2↑+4HNO3 10-10 在超临界水氧化过程中,乙醇先氧化为CO,CO再氧化为CO2(CO为反应中间产物,CO2为反应最终产物) 乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
【解析】
电解海水时,氯离子在阳极区失去电子生成氯气,氯离子向阳极区移动,钠离子向阴极区移动;电解的方程式书写考虑放电顺序,银离子比氢离子先放电,生成银单质;温度升高促进水的电离,水的电离常数增大。
(1)A. 氢气在氧气中燃烧生成液态水的反应是一个放热且熵减的反应,A正确;
B. 该反应是一个自发的氧化还原反应,可以将该反应设计成原电池,将化学能转化为电能,B正确;
C. 该反应无沉淀气体生成,在常温下不易被观察,但因为具有较高的活化能,反应速率小,C正确;
D. 选用合适的催化剂,有可能使氢气和氧气在常温常压下以较快的速率进行,D正确;
所以正确的是ABCD;
(2) ①图中氯离子在左边区域失去电子生成氯气,氯离子要透过膜a,所以膜a应选用阴离子交换膜;
②A区域钠离子和氯离子都减少,所以排出液中为淡化海水;
③电渗析法处理AgNO3废液时,银离子得电子生成银单质,水中氧元素失去电子生成氧气,所以反应的化学方程式为:4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
(3)①常温下Kw =10-14,水电离产生的c(H+)=10-7mol/L,电离度变为常温下的100倍,则此时c(H+)=10-5mol/L,Kw =10-10;
②如图可知,乙醇的超临界水氧化过程中,CO的含量先增大再减小,CO2的含量一直增大,乙醇的含量一直减小,可见CO为反应中间产物,CO2为反应最终产物,所以CO的分布分数先增后降的原因是在超临界水氧化过程中,乙醇先氧化为CO,CO再氧化为CO2(CO为反应中间产物,CO2为反应最终产物);
③温度升高时,反应速率加快,如图可知,单位时间内乙醇氧化生成CO的速率比CO氧化生成CO2的速率快,xCO峰值出现的时间才会提前,且峰值更高,所以原因是乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大。


科目:高中化学 来源: 题型:
【题目】判断下列离子方程式是否正确,错误的指明原因,并写出正确的离子方程式。____。
(1)铁粉溶于稀硫酸中:2Fe+6H+=2Fe3++3H2↑
(2)用三氯化铁溶液制取Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
(3)氢氧化铜溶于盐酸:OH-+H+=H2O
(4)氢氧化钡溶液与硫酸铜溶液混合:2OH-+Cu2+=Cu(OH)2↓
(5)铝与氯化铜溶液发生置换反应:Al+Cu2+=Al3++Cu
(6)硫酸溶液与氢氧化钡溶液混合:H++OH-+SO42-+Ba2+=BaSO4↓+H2O
(7)碳酸钙溶于硝酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O
(8)碳酸氢钙溶液与足量氢氧化钠溶液混合HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使pH试纸变蓝的溶液中:![]() 、Na+、Cl-、ClO-
、Na+、Cl-、ClO-
B.1.0 mol·L-1的HNO3溶液中:K+、[Ag(NH3)2]+、Cl-、![]()
C.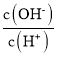 =1的溶液中:Fe2+、
=1的溶液中:Fe2+、![]() 、Al3+、I-
、Al3+、I-
D.0.1 mol·L-1的NH4HCO3溶液中:K+、Na+、![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Sorbicillin(简称化合物X)是生产青霉素时的一个副产品,其结构简式如下图所示。下列有关化合物X的说法不正确的是( )

A.分子中所有碳原子可能处于同一平面
B.1 mol化合物X可以与2 mol Na2CO3反应
C.化合物X可以发生加成、取代、氧化反应
D.化合物X与H2完全加成,每个产物分子中含有4个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。
CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。
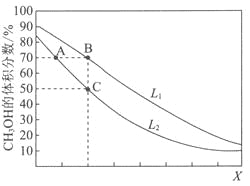
下列说法中,正确的是( )
A.X代表压强B.L1<L2
C.平衡常数:K(A)=K(B)D.在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S与CO2高温下发生反应:H2S(g)+CO2(g) ![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1=________%,反应平衡常数K=___________________。
(2)在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2________α1,该反应的ΔH____0(填“>”“<”或“=”)。
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是______(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产铬单质涉及的反应如下:
Na2Cr2O7+2C![]() Cr2O3+Na2CO3+CO↑
Cr2O3+Na2CO3+CO↑
Cr2O3+2Al![]() 2Cr+Al2O3
2Cr+Al2O3
(1) Cr基态原子的核外电子排布式为________。

(2) Na、O、C的第一电离能从大到小的顺序为________。
(3) 与CO![]() 互为等电子体的一种分子为________(填化学式)。
互为等电子体的一种分子为________(填化学式)。
(4) Cr2O3具有两性,溶于NaOH溶液形成配合物Na[Cr(OH)4]。
Na[Cr(OH)4]中配体的化学式为____________,1 mol该配合物中含σ键数目为_________。
(5) 合金CrAl晶体的晶胞如右图所示,写出该合金的化学式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com