
【题目】KMnO4在生产和生活中有着广泛的用途。某化学小组在实验室制备KMnO4并探究其性质。请回答下列问题:
(一)KMnO4的制备。
步骤I 先利用如图甲所示装置由MnO2制备KMnO4。
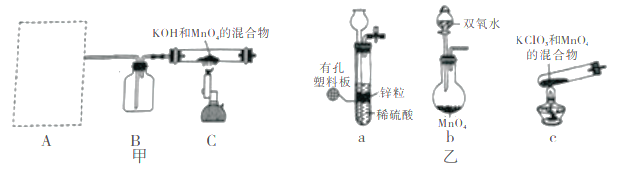
(1)装置A应选用图乙中的_______(填“a”“b”或“c”)。
(2)装置B中所盛试剂的名称为________。
(3)装置C处制备K2MnO4的化学方程式为________。
步骤II 由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:
①充分反应后,将装置C处所得固体加水溶解,过滤;
②向①的滤液中通入足量CO2,过滤出生成的MnO2;
③将②的滤液经过蒸发浓缩、降温结晶、过滤、洗涤、干燥等一系列实验操作,得KMnO4晶体。
(4)过程②向①的滤液中通人足量CO2,其还原产物为_______。
(5)过程③干燥KMnO4时,温度不宜过高的原因是__________。
(二)KMnO4的性质。
KMnO4具有强氧化性。某化学学习小组利用其性质测定H2C2O4溶液的浓度。
反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(6)①滴定终点现象是:当加入最后一滴酸性KMnO4溶液时,溶液颜色______,且半分钟内不褪色。
②c(标准KMnO4溶液)=0.20mol/L,滴定时所得的实验数据如下表,试计算所测H2C2O4溶液的浓度为_______mol/L。
实验次数编号 | 待测液体积(mL) | 滴入的标准液体积(mL) |
1 | 10.00 | 22.95 |
2 | 10.00 | 20.05 |
3 | 10.00 | 19.95 |
【答案】 b 浓硫酸 4KOH+2MnO2+O2![]() 2K2MnO4+2H2O MnO2 防止高锰酸钾高温分解 无色变为紫红色 1.00
2K2MnO4+2H2O MnO2 防止高锰酸钾高温分解 无色变为紫红色 1.00
【解析】
(1)b装置制备氧气;(2)浓硫酸作干燥剂;(3)根据质量守恒写出方程式;(4)向①的滤液中通入足量CO2,过滤出生成的MnO2和高锰酸钾;(5)高锰酸钾不稳定,高温分解(6)根据5H2C2O4 ~2MnO4-,和浓度C=n/V计算。
(1)要生成高锰酸钾,需要强氧化剂,因此A装置提供的气体具有强氧化性,由于二氧化锰能氧化浓盐酸生成氯气,所以装置A应选用b装置,制备氧气。(2)生成的氧气必须干燥,则装置B的作用是干燥氧气,其中所盛试剂的名称为浓硫酸。(3)装置C处反应生成K2MnO4的同时根据原子守恒可知还有水生成,反应的化学方程式为4KOH+2MnO2+O2![]() 2K2MnO4+2H2O 。(4)过程②向滤液中通入足量CO2,锰酸钾转化为二氧化锰和高锰酸钾,(5)过程③干燥KMnO4时,温度不宜过高的原因是:防止高锰酸钾高温分解 。(6)①滴定终点现象是:当加入最后一滴酸性KMnO4溶液时,溶液颜色无色变为紫红色,且半分钟内不褪色。②第1组数据明显有误差,舍去,平均体积为(20.05+19.95)/2=20.00mL
2K2MnO4+2H2O 。(4)过程②向滤液中通入足量CO2,锰酸钾转化为二氧化锰和高锰酸钾,(5)过程③干燥KMnO4时,温度不宜过高的原因是:防止高锰酸钾高温分解 。(6)①滴定终点现象是:当加入最后一滴酸性KMnO4溶液时,溶液颜色无色变为紫红色,且半分钟内不褪色。②第1组数据明显有误差,舍去,平均体积为(20.05+19.95)/2=20.00mL
5H2C2O4 ~2MnO4-
5mol 2mol
n 0.2mol·L-1×0.020L
n=0.01mol,
则C(H2C2O4)=0.01mol/0.010L =1.00mol·L-1,


科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A. v(A)=0.15mol/(L·min) B. v (B)=0.6 mol/(L·min)
C. v (C)=0.3 mol/(L·min) D. v (D)=0.1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验室用如图所示装置制取少量溴苯。请填写下列空白。
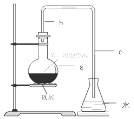
(1)在烧瓶a中装的试剂是苯、溴和铁屑。导管b的作用有两个:一是导气,二是兼起__________的作用。
(2)反应过程中在导管c的下口附近可以观察到白雾出现,这是由于反应生成的________遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有__________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有__________色不溶于水的液体。这是溶解了__________的粗溴苯。
(5)写出烧瓶a中发生反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL(溶液体积有简单叠加),Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是

A. Ka(HX)的值与Kb(NH3·H2O)的值相等
B. c、d两点,![]() 值相等
值相等
C. a→d点过程中,存在c(X-)=c(NH4+)
D. b点,c(NH4+)+c(HX)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末可能是Fe2O3、Cu2O或二者混合物,为探究其组成,称取mg该固体粉末样品,用足量的稀H2SO4充分反应后,称得固体质量为ag。
已知:Cu2O+2H+ = Cu+Cu2++H2O
(1)若a=____________(用含m的最简式表示),则红色固体粉末为纯净物;
(2)若a=m/9,则红色固体粉末中Fe2O3的物质的量为____________mol(用含m的最简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3对比得出的结论是______________________________。
(2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
(4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
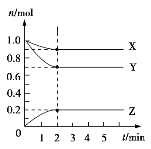
(5)反应开始至2 min,Y的平均反应速率______________________。
(6)分析有关数据,写出X、Y、Z的反应方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中:氧化性IO3—>I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是
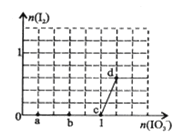
A. a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B. b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C. c点到d点的反应中共转移0.6mol电子
D. 往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5 HSO3- + 2IO3- == I2+ 5SO42-+ 3H++ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图分别表示生物体内的生物大分子的部分结构模式图,据图回答:
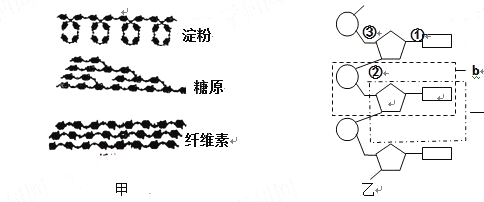
(1)甲图中的三种物质都是由许多 连接而成的,其中属于植物细胞中的储能物质是 。这三种物质中,在功能上与另外两种截然不同的是 ,这种物
质参与细胞中 的构成。
(2)乙图所示化合物的基本组成单位可用图中字母 表示,各基本单位之间是通过 (填①、②或③)连接起来的。
(3)由b形成的多聚体能储存大量的遗传信息,原因是 的排列方式是多样的。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com