
| A. | 中和热(△H)的测定中,若使用简易装置时在大小烧杯之间没有垫碎泡沫塑料(或纸条) | |
| B. | 用标准盐酸滴定氢氧化钠溶液,酸式滴定管洗净后,没有用标准盐酸润洗,所测出的碱液的浓度值 | |
| C. | 食醋总酸含量测定实验中,用移液管移取食醋体积时视线俯视标准线移液 | |
| D. | 在镀锌铁皮的锌镀层厚度的测定中,锌在酸中溶解后没有及时取出 |
分析 A.碎泡沫塑料(或纸条)起隔热保温作用;
B.滴定管未用盐酸标准液润洗,会导致浓度偏低,所用体积判断,则测定结果偏大;
C.俯视标准线移液时体积偏小;
D.Zn、Fe均与稀硫酸反应.
解答 解:A.碎泡沫塑料(或纸条)起隔热保温作用,不垫会使热量损失,所测出的中和热数值偏低,故A正确;
B.滴定管未用盐酸标准液润洗,会导致浓度偏低,所用体积判断,则测定结果偏大,故B错误;
C.俯视标准线移液时体积偏小,测得含量偏小,故C正确;
D.Zn、Fe均与稀硫酸反应,锌在酸中溶解后,应及时取出,否则使结果偏大,故D错误.
故选AC.
点评 本题考查中和热测定、计量仪器及使用方法、实验方案的评价等,难度不大,注意读数时俯视,会使所读取的数值大于液体的实际体积.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
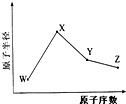 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:8 | |
| B. | 还原产物为NH4+ | |
| C. | 若有1molNO3-参加还原反应,转移8mol e- | |
| D. | 该反应中H2O是反应物之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Ca2+、NO3-、H+ | B. | Fe2+、H+、CO32-、Cl- | ||
| C. | Fe3+、OH-、SO42-、Cl- | D. | Fe3+、NH4+、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
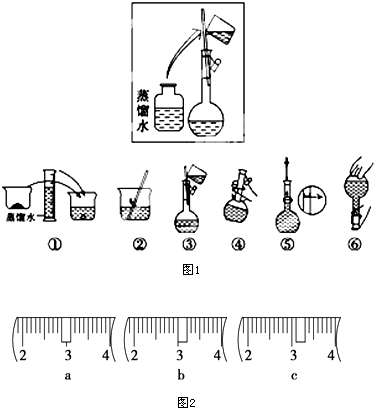 某同学帮助水质检测站配制230mL、1mol•L-1NaOH溶液以备使用.
某同学帮助水质检测站配制230mL、1mol•L-1NaOH溶液以备使用.| a | b | c | d | e | |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com