
 ��
�� +2H2O��
+2H2O��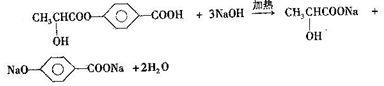 ��
��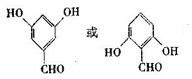 ��
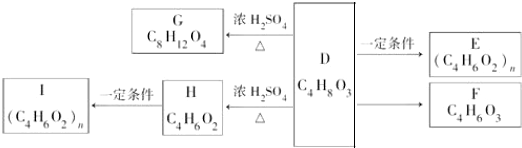
������ A��B��C��D����NaHCO3��Ӧ���������-COOH������A��C����FeCl3��Һ������ɫ��Ӧ��A��C�ṹ�к��з��ǻ���CΪ��Ԫ��״��̨�˵�����б�������D�ķ���ʽ��֪C����6��Cԭ�ӣ���D��H����ʽ��֪D��������ȥ1����ˮ����H����HΪCH2=CHCH2COOH��DΪHOCH2CH2CH2COOH��H�����Ӿ۷�Ӧ����IΪ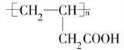 ����D��F�ķ���ʽ��֪D����ȥ��2��Hԭ������F����FΪOHCCH2CH2COOH����D��E����ʽ��֪D�������۷�Ӧ����E����EΪ
����D��F�ķ���ʽ��֪D����ȥ��2��Hԭ������F����FΪOHCCH2CH2COOH����D��E����ʽ��֪D�������۷�Ӧ����E����EΪ ����DΪHOCH2CH2CH2COOH��֪��2����D����������Ӧ����ȥ2����ˮ�γɻ�������GΪ
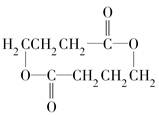
����DΪHOCH2CH2CH2COOH��֪��2����D����������Ӧ����ȥ2����ˮ�γɻ�������GΪ ��A��ϡ����������C��D����ΪD�ķ���ʽΪC4H8O3����C�к��б���������6��̼ԭ�ӣ���C����FeCl3��Һ������ɫ��Ӧ��֪C�б��������ǻ�������NaHCO3��Ӧ��֪C�к����Ȼ����ɱ�������������ԭ�ӿ�֪�Ȼ��ڱ�����λ���ǻ��Ķ�λ����CΪ
��A��ϡ����������C��D����ΪD�ķ���ʽΪC4H8O3����C�к��б���������6��̼ԭ�ӣ���C����FeCl3��Һ������ɫ��Ӧ��֪C�б��������ǻ�������NaHCO3��Ӧ��֪C�к����Ȼ����ɱ�������������ԭ�ӿ�֪�Ȼ��ڱ�����λ���ǻ��Ķ�λ����CΪ ����AΪ
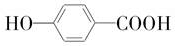
����AΪ ��A��B�ķ���ʽ��ΪC11H12O5����B��ϡH2SO4�м���Ҳ������C��D����C��D�Ľṹ��ʽ��B����NaHCO3��Ӧ���ɵó�B�Ľṹ��ʽΪ
��A��B�ķ���ʽ��ΪC11H12O5����B��ϡH2SO4�м���Ҳ������C��D����C��D�Ľṹ��ʽ��B����NaHCO3��Ӧ���ɵó�B�Ľṹ��ʽΪ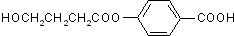 ���ݴ˽��
���ݴ˽��
��� �⣺��1���������Ϸ�������ӦD��HΪD��������ȥ1����ˮ����H����Ӧ����Ϊ��ȥ��Ӧ��DΪHOCH2CH2CH2COOH��FΪOHCCH2CH2COOH����D��F�ķ�Ӧ����ΪCu��O2���ȣ�F�й����ŵ�����Ϊȩ�����Ȼ����ʴ𰸣���ȥ��Ӧ��Cu��O2���ȣ�ȩ�����Ȼ���
��2���������Ϸ�����C�Ľṹ��ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3��DΪHOCH2CH2CH2COOH��GΪ ��2����D����������Ӧ����ȥ2����ˮ�γɻ���G������D��G�Ļ�ѧ����ʽΪ��2HOCH2CH2CH2COOH$?_{��}^{Ũ����}$
��2����D����������Ӧ����ȥ2����ˮ�γɻ���G������D��G�Ļ�ѧ����ʽΪ��2HOCH2CH2CH2COOH$?_{��}^{Ũ����}$ +2H2O���ʴ�Ϊ��2HOCH2CH2CH2COOH$?_{��}^{Ũ����}$
+2H2O���ʴ�Ϊ��2HOCH2CH2CH2COOH$?_{��}^{Ũ����}$ +2H2O��
+2H2O��
��4���������Ϸ�����BΪ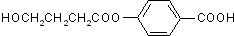 ������B��NaOH��Һ�й��ȵĻ�ѧ����ʽΪ��
������B��NaOH��Һ�й��ȵĻ�ѧ����ʽΪ��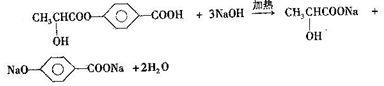 ���ʴ�Ϊ��
���ʴ�Ϊ��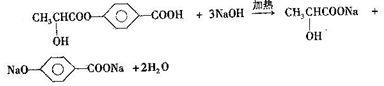 ��
��
��5���������Ϸ�����C�Ľṹ��ʽΪ ��������FeCl3 ��Һ������ɫ��Ӧ��˵�����з��ǻ������ܷ���������Ӧ������ˮ�⣬˵������ȩ�����۱����ϵ�һ±����ֻ��2�֣�˵���ṹ�Գƣ���������Ҫ���ͬ���칹��Ľṹ��ʽΪ��
��������FeCl3 ��Һ������ɫ��Ӧ��˵�����з��ǻ������ܷ���������Ӧ������ˮ�⣬˵������ȩ�����۱����ϵ�һ±����ֻ��2�֣�˵���ṹ�Գƣ���������Ҫ���ͬ���칹��Ľṹ��ʽΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
���� ���⿼���л��ƶ���ϳɣ��漰��������ȩ�������Լ�ѧ��������Ϣ�����ȡ֪ʶ���������Ƕ��л�������֪ʶ���ۺϿ��飬�ܽϺõĿ��鿼�����Ķ�����˼ά���������ø������Ϣȷ���л���ṹ�DZ���ؼ�֮����ע����ݷ�Ӧ����������ʽ���н����ƶϣ��Ǹ߿��ȵ����ͣ��Ѷ��еȣ�


 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C��ˮ������������ȡˮú�� | B�� | ����ϡ���� | ||
| C�� | ���ȷ�Ӧ | D�� | ������O2��ȼ�շ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ���ŨH2SO4����170�� | B�� | ��ϩʹ��ˮ��ɫ | ||
| C�� | �ױ���Ũ���ᡢŨ������ | D�� | ����Cl2һ�������������Ȼ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �۷е㣺S��NaCl��SiO2 | |
| B�� | ���ԣ�HNO2��HNO3��H3PO4��H2SO4 | |
| C�� | ���ǣ�H2O��H-O-H��NH3��H-N-H��CH4��H-C-H | |
| D�� | ������C-H��O-H |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʳƷ�м�����ɫ�� | B�� | �ִ�����װп����� | ||
| C�� | �ڸ���װ�ڷ��ÿ������� | D�� | ȼú����ʱ��ú�۴���ú�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
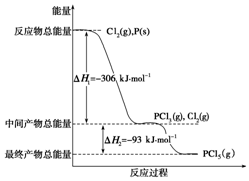 ����P��s����Cl2��g��������Ӧ����PCl3��g����PCl5��g������Ӧ���̺�������ϵ��ͼ��ʾ��ͼ�еġ�H��ʾ����1mol��������ݣ�������ͼ�ش��������⣺
����P��s����Cl2��g��������Ӧ����PCl3��g����PCl5��g������Ӧ���̺�������ϵ��ͼ��ʾ��ͼ�еġ�H��ʾ����1mol��������ݣ�������ͼ�ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧ�� | C-H | O-H | C=O | H-H |
| ����������kJ/mol�� | 414 | 464 | 803 | 436 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 X��Y��Z��W��Ϊ����������Ԫ�أ�������������Ӧˮ��������£�Ũ�Ⱦ�Ϊ0.1mol•L-1����pH��ԭ�������Ĺ�ϵ��ͼ��ʾ�������й�˵����ȷ����
X��Y��Z��W��Ϊ����������Ԫ�أ�������������Ӧˮ��������£�Ũ�Ⱦ�Ϊ0.1mol•L-1����pH��ԭ�������Ĺ�ϵ��ͼ��ʾ�������й�˵����ȷ����| A�� | �����Ӱ뾶��W��Z��Y��X | B�� | ���⻯���ȶ��ԣ�X��Z��W | ||
| C�� | ����þ�Ͻ�ʱ������X2�������� | D�� | ������Y2Z2�д������Ӽ����ۼ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com