
【题目】硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)39H2O]的流程如图甲:
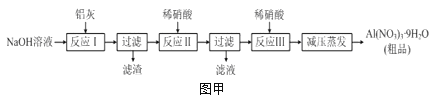
(1)写出反应Ⅰ的离子方程式:______________________________________________。
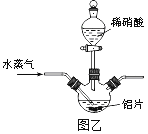
(2)若用图乙所示实验装置制取Al(NO3)3,通入水蒸气的作用是__________________。
(3)上述流程中采用减压蒸发,并控制反应Ⅲ中加入的稀硝酸稍过量,其目的是__________。
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和某气体。已知:2NO2+2NaOH=NaNO2+NaNO3。为了确定生成气体的成分,某学生拟用下列装置进行实验。
①进行实验时装置接口正确顺序是A→________________________→F。
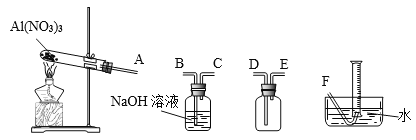
②证明分解生成的混合气体中有NO2的现象是_____________________。
③取21.3g Al(NO3)3加热分解,用排水法收集气体,最终在标准状况下收集到_____mL气体,结合化学方程式说明理由____________________________。
(5)设计实验证明粗品中含有Al(NO3)3:_________________________。
【答案】
(1)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑、Al2O3+2OH﹣=2AlO2﹣+H2O(2分)
(2)提高温度、搅拌,加快反应速率(1分)
(3)抑制硝酸铝水解(1分)
(4)①E→D→B→C(2分)
②加热后大试管、安全瓶中出现棕红色气体,通过NaOH溶液的洗气瓶后棕红色气体消失(2分)
③0(1分)
因为4Al(NO3)32Al2O3+12NO2↑+3O2↑;4NO2↑+O2↑+2H2O=4HNO3,故收集不到气体(2分)
(5)取少量粗品于试管中加水溶解,再向试管中滴加NaOH溶液,先产生白色沉淀,后沉淀又溶解,证明含有Al3+;另取少量粗品于试管中,向试管中加入70%的H2SO4,再加入铜片,在试管上方产生棕红色气体,说明含有NO3-。(或加热粗品,有红棕色气体产生,说明含有NO3-)(3分)
【解析】
试题分析:流程是铝灰用氢氧化钠溶液溶解,铝、氧化铝反应生成偏铝酸钠,氧化铁不反应,过滤分离,滤液中含有偏铝酸钠、未反应的NaOH,加入硝酸中和未反应的氢氧化钠,并将偏铝酸钠转化为氢氧化铝沉淀,再过滤分离,氢氧化铝沉淀再用硝酸溶解,得到硝酸铝溶液,经过减压蒸发得到硝酸铝晶体。
(1)反应Ⅰ涉及:铝与氢氧化钠反应生成偏铝酸钠与氢气,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑、Al2O3+2OH﹣=2AlO2﹣+H2O;
(2)由于水蒸气温度较高,可以升高反应体系的温度,且可以起搅拌作用,可以加快反应速率;
(3)硝酸铝容易发生水解,减压蒸发、反应Ⅲ中加入的稀硝酸稍过量,都可以抑制硝酸铝水解;
(4)①因为NO2易溶于水,大试管应先防倒吸接E→D,再吸收NO2接B→C;
②加热生成NO2,故大试管、安全瓶中出现棕红色气体,通过NaOH溶液的洗气瓶后棕红色气体消失。
③因为4Al(NO3)32Al2O3+12NO2↑+3O2↑;4NO2↑+O2↑+2H2O=4HNO3,故收集不到气体。
(5)取少量粗品于试管中加水溶解,再向试管中滴加NaOH溶液,先产生白色沉淀,后沉淀又溶解,证明含有Al3+;另取少量粗品于试管中,向试管中加入70%的H2SO4,再加入铜片,在试管上方产生棕红色气体,说明含有NO3-。(或加热粗品,有红棕色气体产生,说明含有NO3-)。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | b | ||||||||||||||||
c | d | e | |||||||||||||||
f | g | ||||||||||||||||
试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: 。
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) 。
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f3+ 的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
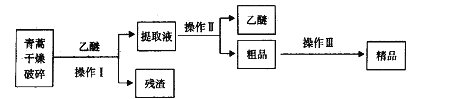
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、___________,操作Ⅱ的名称是_________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是____________,装置F中盛放的物质是______________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:
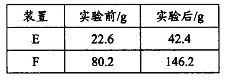
则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:
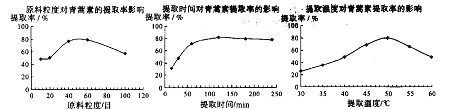
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl—)为原料生产CuCl的流程如下:
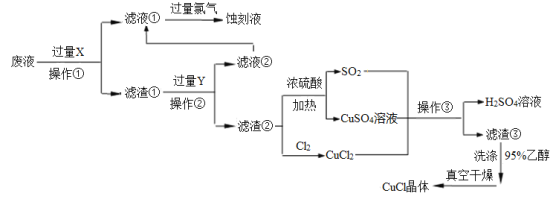
已知:CuCl是一种白色粉末,微溶于水,不溶于乙醇及稀硫酸,在水溶液中存在平衡:
CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液);在空气中迅速被氧化成绿色;见光则分解,变成褐色。
[CuCl3]2-(无色溶液);在空气中迅速被氧化成绿色;见光则分解,变成褐色。
根据以上信息回答下列问题:
(1)试剂X是______,检验刻蚀液中金属阳离子的化学试剂是_____。(均填化学式)
(2)操作①、②、③相同,名称是________,所需要的主要玻璃仪器有烧杯、___ 、_____。
(3)滤渣①与Y反应的离子方程式为_________________。
(4)产生CuCl的化学方程式为_______________,当观察到 现象,即表明反应已经完全。
(5)在操作③之前往往向反应后的溶液中加入大量的水,其作用是 。
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是短周期非金属元素,核电荷数依次增大。A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素。D、E是第四周期元素,其中E元素的核电荷数为29。D原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物易液化的原因是 ;
(3)已知A、C形成的化合物分子甲会造成温室效应,l mol甲中含有π键的数目为 ;
(4)基态D原子的外围电子排布式为 。DO2Cl2熔点:-96 .5℃,沸点: 117℃,则固态DO2Cl2属于 晶体。

(5)E的氢化物的晶胞结构如图所示,其化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
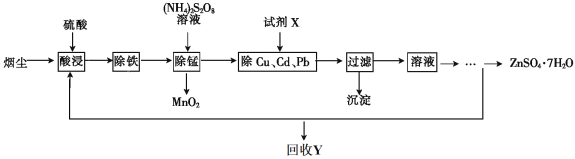
【题目】【化学——选修2化学与技术】将“废杂铜烟尘”用硫酸吸收浸取,既可保护环境又可得到用途广泛的高纯硫酸锌。已知烟尘中主要含ZnO,还有少量的FeO、Fe2O3、CuO、MnO、PbO、CdO。制备工艺流程如下:
已知:相关金属离子生成氢氧化物沉淀的pH及沉淀完全的pH如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Zn2+ | 5.5 | 8.0 |
Fe2+ | 5.8 | 8.8 |
(1)回收的产品Y是_____________________。
(2)“除铁”时,先加入_________________(氧化剂、还原剂),再将溶液的pH调整到__________。
(3)“除锰”时溶液中发生反应的化学方程式为____________________。
(4)除去Cu、Cd、Pb的同时可以回收一些重金属,试剂X为__________________。
(5)ZnSO4溶液经过__________、__________、过滤及干燥得到ZnSO4·7H2O。
(6)为了测定产品中ZnSO4·7H2O的含量,取ag产品溶于水,向所得溶液中慢慢加入碳酸钠溶液至沉淀完全;过滤、洗涤沉淀,在将沉淀固体煅烧至完全分解,称得为bg,则产品中ZnSO4·7H2O的质量分数是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是一种重要的液体化工原料,沸点38.4 ℃,难溶于水且为非电解质,可与碱溶液反应。实验室中可利用如下原理制取少量溴乙烷:
H2SO4(浓)+NaBr+C2H5OH→C2H5Br+NaHSO4。
某研究性学习小组的同学设计了如图所示的装置(支持及加热仪器已省略)来制备溴乙烷,并验证有副产物SO2、CO2、C2H4生成(SO2沸点10 ℃)。

(1)仪器B的名称是________,装置D用来检验并除去乙烯,则D中的试剂是________,F的用途是_____________________________________________________,证明一定有CO2生成的现象是__________________________________。
(2)C中所得到的溴乙烷中含有少量的乙醇、Br2、HBr。为得到纯净的溴乙烷,该同学取出C中的液体依次用水洗→___________洗→水洗,再用__________干燥,最后进行蒸馏。洗涤实验中,所用的玻璃仪器除烧杯外还一定需要的仪器名称是__________。
(3)假设上述实验都得到了预期的实验现象,写出乙醇与浓硫酸反应生成上述无机气体时的化学方程式:___________________________________。
(4)小组的同学对产品有存在溴单质的原因及验证方法进行了分析讨论。
①含有溴单质的依据是__________________________________。
②请设计一种实验方案,利用化学方法证明C中的液体中含有单质溴:_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末X中含有K2SO3、K2CO3、FeO、MnO2等物质,现取X进行连续实验,实验过程及产物如下:
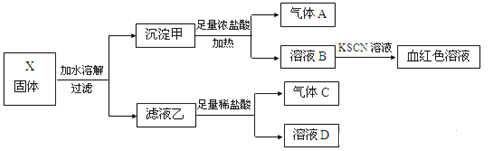
请回答:
(1)气体C的主要成分(填化学式)________。
(2)溶液B中存在的所有阳离子是___________________ 。
(3)沉淀甲中加浓盐酸产生气体A的离子方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的次外层电子数比最外层电子数多4个,E元素原子最外层与最内层电子数的差是3,试回答:
(1)写出下列元素的元素符号:A _____ C _____ D ____ _ E _____ 。
(2)用电子式表示B和F形成化合物的过程:_____ 。
(3)D在周期表中的位置_____ ,E的氢化物中化学键类型是 ,比较D与E氢化物的稳定性 (用化学式填空);
(4)写出C、F两种元素最高价氧化物的水化物相互反应的化学方程式: ___ _____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com