
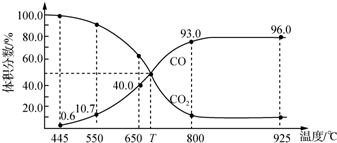
| A. | 550℃时,若充入惰性气体,v(正)、v(逆)均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,此反应的平衡常数K=2 304,保持温度不变,若缩小体积,K值将变小 |
分析 A.可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,则v正,v退均减小,又改反应是气体体积增大的反应,则平衡正向移动;
B.由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,根据三段式进行计算;
C.由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态;
D.平衡常数只与温度有关.
解答 解:A.可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,平衡向着正向移动,v正,v逆均减小,故A错误;
B.由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,
则有C(s)+CO2(g)?2CO(g)
开始 1 0
转化 x 2x
平衡; 1-x 2x
所以$\frac{2x}{1-x+2x}$×100%=40%,解得x=0.25mol,则CO2的转化率为:$\frac{0.25}{1}$×100%=25%,故B正确;
C.由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,所以平衡不移动,故C错误;
D.925℃时,平衡常数只与温度有关,缩小体积,K不变,故D错误.
故选:B.
点评 本题考查了化学平衡的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能小于O原子 | 同周期元素原子的电离能随原子序数增大而增大 |
| B | CO2为直线形分子 | CO2分子中C为sp杂化,键角为180° |
| C | 金刚石的熔点高于石墨 | 金刚石是原子晶体,石墨是分子晶体 |
| D | HF的沸点低于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 既能与酸反应,又能与碱反应 | |
| B. | 导电性好 | |
| C. | 熔点低 | |
| D. | 具有还原性,在冶炼反应中放出大量的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①③⑥ | C. | ②③④ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
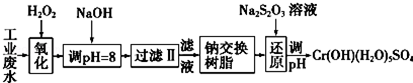
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
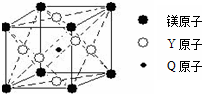 Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:| 元素 | 相关信息 |
| Q | Q的单质是实验室常用的惰性电极材料 |
| R | R原子基态时2p原子轨道上有3个未成对电子 |
| T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
| X | X是第三周期电负性最大的元素 |
| Y | 元素Y位于周期表第10列 |
| Z | Z存在质量数为65,中子数为36的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4句 | B. | 5句 | C. | 6句 | D. | 7句 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com