
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
| 浓度(mol·L-1) | 体积(mL) | 浓度(mol·L-1) | 体积 (mL) | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
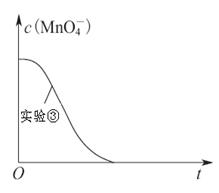
(1)2 2.5(或5:2) (2)②和③, ①和② (3)0.010
(4)
解析试题分析:(1)高锰酸钾溶液与草酸反应的化学方程式为:2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + MnSO4 + 10CO2↑+ 8H2O,反应中C的化合价由+3价升高到+4价,所以每消耗1molH2C2O4转移2mol电子;为了观察到紫色褪去,则KMnO4必须完全反应,从方程式可看出:n(H2C2O4) n(KMnO4)≥5∶2。(2)分析表中数据可看出,②和③两个实验仅温度不同,①和②两个实验仅草酸浓度不同,所以探究温度对化学反应速率影响的实验是②和③,探究反应物浓度对化学反应速率影响的实验是①和②。(3)用KMnO4溶液表示的平均反应速率为: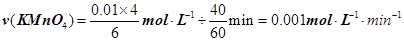 。(4)实验比较实验的反应温度低,则反应速率小,KMnO4溶液褪色时间长,c(MnO4-)~t的变化曲线示意图见答案。
。(4)实验比较实验的反应温度低,则反应速率小,KMnO4溶液褪色时间长,c(MnO4-)~t的变化曲线示意图见答案。
考点:考查外界条件对化学反应速率影响的实验设计、评价与表达,考查综合分析能力和图表处理能力。


科目:高中化学 来源: 题型:填空题
某工厂以天然气、水蒸气和空气为原料和能源合成氨的流程如右图: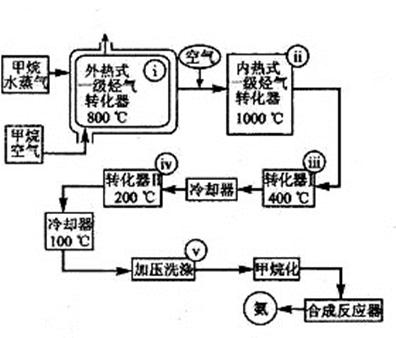
该流程中外热式一级烃转化器系指以 CH4为燃料在烃气转化器外面加热使之维持 8000C高温的工业装置。内热式一级烃气转化器系指以H2在装置内燃烧为能量维护一级烃气转化器所生成的CO与H2O(g)反应生成CO2和H2所需10000C高温的装置。在编号为i-v的反应器中发生如下反应:
| A.CH4+2O2=CO2 +2H2O | B.CH4+H2O(g)=CO +3H2 |
| C.2CH4+3H2O(g)=CO + CO2 +7H2 | D.K2CO3+CO2 +H2O=2KHCO3 |
 CO2 + H2ΔH<0 F.2H2 +O2=2H2O
CO2 + H2ΔH<0 F.2H2 +O2=2H2O查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为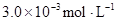 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA 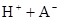 | 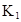 | 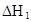 | 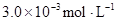 |
在苯中,2HA 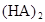 | 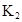 | 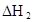 | 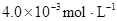 |
 (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则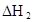 ___________0。
___________0。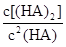 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
 CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的 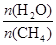 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: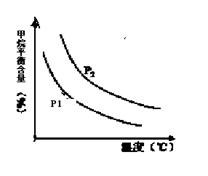
 CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 ;
(2)x= ;
(3)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)=
mol;
(4)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在某温度下,体积恒定的密闭容器中加入2 molN2和4 molH2,发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
(1)达到平衡时,N2的转化率为_______________, NH3的体积分数为 。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。a、b、c取值必须满足的一般条件是 , 。
(3)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池总反应式为:4NH3+3O2=2N2+6H2O,电解质溶液应显 (填“酸性” 、“中性” 或“碱性” ),写出正极的电极反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g) 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
| 反应时间/min | n(NO2)/mol | n(NH3)/ mol |
| 0 | 1.20 | 1.60 |
| 2 | 0.90 | |
| 4 | | 0.40 |
 CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将 移动(填向左,向右,不);CO的浓度将 (增大,减小,不变)
CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将 移动(填向左,向右,不);CO的浓度将 (增大,减小,不变)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):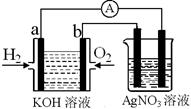
(1)对于氢氧燃料电池中,下列表达不正确的是________
| A.a电极是负极,OH-移向正极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
 2NH3(g) ΔH=-92.20 kJ·mol-1。
2NH3(g) ΔH=-92.20 kJ·mol-1。| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com