

分析 (1)用水分解或电解都要消耗能源,天然气也是有限资源,只有太阳能是取之不尽用之不竭的能源;
(2)注意催化剂可降低反应所需的活化能;
(3)①根据图象计算v(CO2),根据反应速率之比等于化学计量数之比计算;
②使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量.
解答 解:(1)用水分解或电解都要消耗能源,天然气也是有限资源,只有太阳能是取之不尽用之不竭的能源,
A、消耗电能,不是最节能的方法,故A错误;
B、消耗热能,不是减碳的手段,故B错误;
C、利用太阳光催化分解水制氢是最节能的,故C正确;
D、天然气是非再生能源,且不是最节能的方法,故D错误;
故答案为:C;
(2)该反应△H>0,为吸热反应,所以生成物能量高于反应物,使用催化剂可降低反应的活化能,故可画出图为: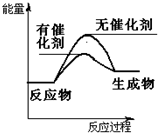 ,
,
故答案为: ;
;
(3)①由图象可知:v(CO2)=$\frac{0.25mol/L}{7min}$,则v(H2)=3v(CO2)=3×$\frac{0.25mol/L}{7min}$=0.11mol/(L•min),故答案为:0.11;
②使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量,
A、该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误;
B、恒温恒容再充入1mol CO2,虽然平衡正向移动,但是根据勒夏特列原理改变外界条件,平衡移动只能减弱这种改变,不能消除,所以n(CH3OH)/n(CO2)变小,故B错误;
C、将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确;
D、再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
E.将CH3OH(g)从体系中分离出来,减小了CH3OH(g)的浓度,虽然平衡正向移动,但是根据勒夏特列原理改变外界条件,平衡移动只能减弱这种改变,不能消除,所以n(CH3OH)/n(CO2)变小,故E错误;
F.使用高效催化剂,平衡不移动,所以n(CH3OH)/n(CO2)不变,故F错误;
故答案为:CD.
点评 本题主要考查了绿色化学、化学反应中的能量变化、影响化学平衡移动的条件等知识点,中等难度,注重对基本原理的理解.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 4L 0.5mol•L-1NaCl溶液 | B. | 1L 0.3mol•L-1Na2SO4溶液 | ||
| C. | 2L 0.15mol•L-1Na2CO3溶液 | D. | 0.8L 0.4mol•L-1NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 甲苯与氯气在光照下反应主要生成2-氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 原子晶体中的相邻原子间可能存在极性共价键 | |
| C. | 离子晶体中可能含有共价键 | |
| D. | 金属晶体的熔点和沸点都很高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 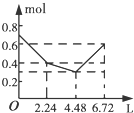 | B. |  | C. |  | D. | 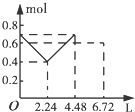 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均存在电离平衡和水解平衡 | |
| B. | 分别加入NaOH固体,恢复至原温,c(CO32-)均增大 | |
| C. | c(OH-)前者大于后者 | |
| D. | 存在的粒子种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| B. | 1 L 1 mol•L-1 NH4NO3溶液中氮原子数小于2NA | |
| C. | 常温常压下,11.2 g乙烯中含有共用电子对数目为2.4NA | |
| D. | 标准状况下,22.4 L CHCl3中所含有的分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com