
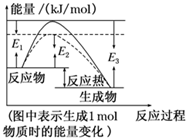
 可逆反应N2+3H2?2NH3是工业上合成氨的重要反应.
可逆反应N2+3H2?2NH3是工业上合成氨的重要反应.分析 ①由图1可知反应物的总能量大于生成物的总能量,则该反应为放热反应,生成1mol氨气时放出的热量为(E3-E1)kg,然后利用化学计量数与反应热的关系并标明物质的状态来书写热化学反应方程式;
②根据图中虚线部分降低了反应所需的活化能,结合反应热不变来分析;
③当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,据此解答.
解答 解:①由图可知该反应为放热反应,且生成1mol生成物放出的热量为(E3-E1)kg,则生成2mol生成物放热为2(E3-E1)kg,即该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-2(E3-E1)kg/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(E3-E1)kg/mol;
②图1中虚线部分改变了反应的途径,从而降低了反应所需的活化能,但反应热不变,则改变的条件应为使用催化剂,
故答案为:使用催化剂;
③当反应达到平衡状态时,正逆反应速率相等,v正(N2)=3v逆(H2)能表明正逆反应速率相等,其余的都不能表示,故答案为:C.
点评 本题考查热化学方程式书写、化学反应速率及化学平衡状态判断,掌握影响反应速率及化学平衡的影响因素即可解答.


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8O2的酯有4种结构 | |
| B. | 淀粉和纤维素互为同分异构体 | |
| C. | 乙醇和葡萄糖均能发生酯化反应 | |
| D. | 用氢氧化钠溶液可以鉴别地沟油和矿物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的盐酸和pH=11的氨水 | |
| B. | pH=3的盐酸和pH=11的氢氧化钡溶液 | |
| C. | pH=3的硫酸和pH=11的氨水 | |
| D. | pH=3的醋酸和pH=11的氢氧化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
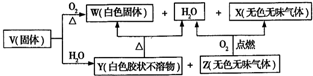
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
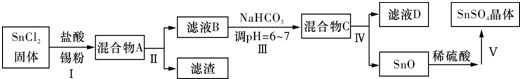
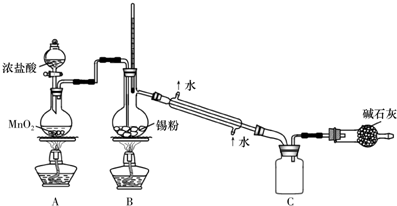
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s 的平均速率 (PCl3)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时 (PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,反应达到平衡前 (正)>(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com