
下列有关实验装置进行的相应实验,能达到实验目的的是( )
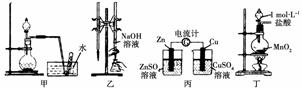
A.用图甲装置进行稀硝酸与铜的反应制取并收集NO
B.用图乙装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
C.用图丙装置检验电流的方向
D.用图丁装置制取少量Cl2
科目:高中化学 来源: 题型:
某化学小组在实验室中利用CaSO4、NH3、CO2制备(NH4)2SO4,工艺流程如下。
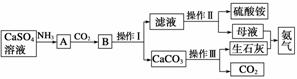
回答下列问题:
(1)操作Ⅰ的名称________,操作Ⅱ需要用到的仪器有铁架台(带铁圈)、酒精灯、玻璃棒和________。
(2)所得母液显酸性的原因用离子方程式表示为______________。检验该溶液含有铵根离子的方法是____________________________。
(3)下列装置能用于实验室制氨气的是________(填序号)。
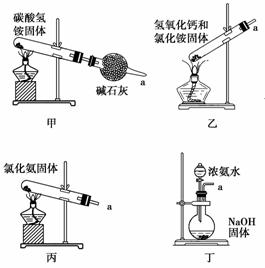
选择氨气的制取装置后,再选用下列装置收集干燥的氨气,并制取硫酸铵溶液,连接的顺序(用接口序号字母表示)是:a接__________________________。
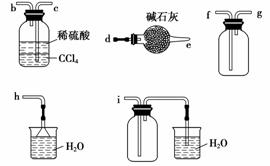
(4)该小组还通过实验研究氨气的性质。
利用下图所示装置探究NH3能否被NO2氧化(K1、K2为止水夹,夹持固定装置略去)。
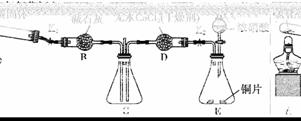
E装置中制取NO2反应的离子方程式是____________。A中发生反应的化学方程式为__________________。
若NH3能被NO2氧化全部生成无毒物质,预期观察到C装置中的现象是____________。若此反应转移电子0.4 mol,则消耗标准状况下的NO2________ L。
实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NO2氧化性较弱,不能将NH3氧化;
②在此条件下,NH3的转化率极低;
③________________________________________________________________________。
此实验装置存在一个明显的缺陷是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
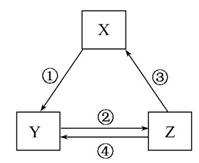
下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是( )
| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | CaO | Ca(OH)2 | CaCO3 | ①常温加水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | Fe | FeCl2 | FeCl3 | ④加入铁粉 |
| D | Cl2 | Ca(ClO)2 | HClO | ③加浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确且能达到预期目的的是( )
| 实验目的 | 操作 | |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2===CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫色是否褪去 |
| ③ | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| ⑥ | 比较碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO2水溶液的pH |
A.①④⑤ B.②③⑤
C.①⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计能够达到目的的是( )
| 编号 | 实验目的 | 实验设计 |
| A | 证明盐酸酸性比醋酸强 | 用同一电路测等体积盐酸、醋酸溶液的导电性 |
| B | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
| C | 证明钠的金属活动性比铜强 | 向CuCl2溶液中投入金属钠 |
| D | 证明溶液中含有I- | 向溶液中加入淀粉溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
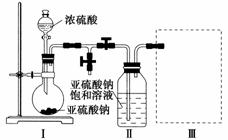
(1)装置Ⅰ中产生气体的化学方程式为________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是________________________。
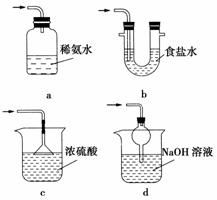
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO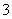 的电离程度大于水解程度,可采用的实验方法是 ________ (填序号)。
的电离程度大于水解程度,可采用的实验方法是 ________ (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
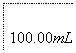
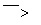

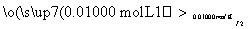 溶液出现蓝色且30 s内不褪色
溶液出现蓝色且30 s内不褪色
(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是( )
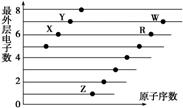
A.X和R在同一周期
B.原子半径:W>R>X
C.气态氢化物的稳定性:Y>X
D.X、Z形成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:

请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式______________;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为n(H2SO4)∶n(HNO3)=__________。
(2)乙方案:将6.4 g铜丝放到90 mL 1.5 mol·L-1的稀硫酸中,控温在50 ℃。加入40 mL 10%的H2O2,反应0.5 h,升温到60 ℃,持续反应1 h后,经一系列操作,得CuSO4·5H2O 20.0 g[已知有关摩尔质量:M(Cu)=64 g·mol-1,M(CuSO4·5H2O) =250 g·mol-1]。
①反应时温度控制在50~60 ℃,不宜过高的原因是______________;
②本实验CuSO4·5H2O的产率为______________。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4,然后过滤、浓缩、结晶。
①物质A可选用以下的________(填序号);
A.CaO B.NaOH C.CuCO3
D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是______________;
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条):____________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应的描 述中正确的是( )
述中正确的是( )
A.需 要加热才能发生的反应一定是吸热反应
要加热才能发生的反应一定是吸热反应
B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀
溶液与稀醋酸完全中和,放出57.3 kJ的热量
C.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为2CO(g)+O2(g)==2CO2(g)
ΔH=- 283.0 kJ·mol-1
283.0 kJ·mol-1
D.已知2C(s)+2O2(g)= ==2CO2(g) ΔH=a,2C(s)+O2(g)===2CO(g) ΔH=b,则b>a
==2CO2(g) ΔH=a,2C(s)+O2(g)===2CO(g) ΔH=b,则b>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com