
【题目】25℃时,把0.2molL﹣1的醋酸加水稀释,则图中的纵轴y表示的是( ) 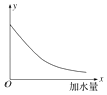
A.溶液中OH﹣的物质的量浓度
B.溶液的导电能力
C.溶液中的 ![]()
D.CH3COOH的电离程度
【答案】B
【解析】醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,溶液的导电能力与离子浓度成正比,温度不变,醋酸的电离平衡常数不变,以此解答该题.
解:A.加水稀释,促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子浓度逐渐减少,OH﹣的物质的量浓度逐渐增大,故A错误;
B.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子、醋酸根离子浓度逐渐减少,溶液的导电能力逐渐减小,故B正确;
C.因温度不变,则K不变,且K= ![]() ,因c(H+)浓度减小,则
,因c(H+)浓度减小,则 ![]() 增大,故C错误;
增大,故C错误;
D.加水稀释,促进电离,醋酸的电离程度增大,故D错误.
故选B.
【考点精析】掌握弱电解质在水溶液中的电离平衡是解答本题的根本,需要知道当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


科目:高中化学 来源: 题型:
【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
I.一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,是重要的水的消毒剂。
(1)写出NH2C1的电子式______________________。
(2)写出NH2C1与水反应的化学方程式______________________。
(3)一定条件下(T℃、1.01×105Pa),可以用Cl2(g)和NH3(g)制得NH2Cl(g),同时得到HCl(g)。已知部分化学键的键能如下表:

写出该反应的热化学方程式____________________________________。
Ⅱ.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) ![]() 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比![]() 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
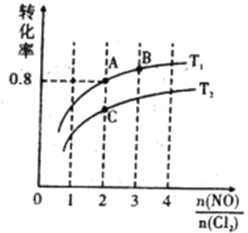
(4)图中T1、T2的关系为:T1______T2 (填“>”、“<”或“=”)
(5)图中纵坐标为物质__________的转化率,理由为___________________________。
(6)图中A、B、C三点对应的NOCl体积分数最大的是________(填“A”、“B”、或“C”)。
(7)若容器容积为1L,则B点的平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列家庭小实验中不涉及化学变化的是( )
A. 用熟苹果催熟青香蕉 B. 用少量食醋除去水壶中的水垢
C. 用糯米、酒曲和水制成甜酒酿 D. 用饱和碳酸钠溶液除去乙酸乙酯中的乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验能获得成功的是( )
A. 用酸性KMnO4溶液鉴别乙烯和乙炔
B. 银镜反应实验后试管内壁附有银,可用氨水清洗
C. 为除去苯中少量的苯酚,可加入足量浓溴水后过滤
D. 为除去乙酸乙酯中少量的乙酸,可用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为 ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) ![]() Fe(s)+CO2(g)△H<0,欲提高上述反应CO的平衡转化率,可采取的措施是( )
Fe(s)+CO2(g)△H<0,欲提高上述反应CO的平衡转化率,可采取的措施是( )
A.提高反应温度
B.移出部分CO2
C.加入合适的催化剂
D.减小容器的容积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,37g37Cl2中所含的中子数为20NA
B. 标准状况下,11.2L三氯甲烷所含C-C1键数目为1.5NA
C. 若将1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
D. 一定条件下,0.2molSO2与足量O2充分反应,生成SO3分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M、N、Q的转化关系如下图所示,下列说法正确的是
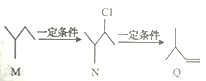
A. M 的名称是2一甲基一丁烷
B. N在NaOH 的水溶液中发生消去反应生成Q
C. Q分子中所有的碳原子一定共面
D. N 的同分异构体有7 种(不考虑立体异构,不包括本身)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置研究电化学腐蚀及防护。关于I和II的叙述正确的是

A. 负极反应均是Fe-2e → Fe2+
B. 正极反应均是O2+2H2O+4e → 4OH-
C. 均是化学能转变为电能
D. 铁均被保护
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界文明古国,商周时期就制造出了“四羊方尊”、“ 司母戊鼎”等精美青铜器。青铜的主要成分是Cu,还含有少量第ⅣA族的Sn和Pb。回答下列问题:
(1)基态Cu原子的价电子排布图是___________________,基态Sn原子的未成对电子数是Cu的__________倍,Pb位于周期表的______________区。
(2)向CuSO4溶液中加入过量的氨水再加少许乙醇可以析出美丽的蓝色晶体:[Cu(NH3)4]SO4·H2O。
①SO42-中S的杂化方式是___________,晶体所含非金属中电负性最小是__________________。
②请表示出[Cu(NH3)4]2+离子中的全部配位键____________,1mol[Cu(NH3)4]2+中含有_____molσ键。
③水分子的键角为1050,小于NH3分子键角1070,产生此差异的原因是_______________。
(3)铜晶胞模型如图所示: ,Cu晶胞的棱长为bpm,则1个铜晶胞中Cu原子的质量是____g,1个铜晶胞中Cu原子占据的体积为______________pm3。
,Cu晶胞的棱长为bpm,则1个铜晶胞中Cu原子的质量是____g,1个铜晶胞中Cu原子占据的体积为______________pm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com