
【题目】某化学学习小组用某种粗盐进行提纯实验,步骤如图所示:已知粗盐中含有的杂质离子主要为:Mg2+、Ca2+、Fe3+、SO42-。

(1)步骤①和②的操作名称是___,所需要玻璃仪器为___。
(2)步骤②中在加入Na2CO3溶液之前还需加入过量NaOH溶液和BaCl2溶液,固体A是:___、___、Fe(OH)3 、BaSO4、BaCO3 (用化学式表示)
(3)步骤②中检验SO42-沉淀完全的操作是:___;
(4)步骤③中加入盐酸的作用是(用离子方程式表示)___;
(5)步骤④的操作为:___、过滤。
【答案】过滤 漏斗、烧杯、玻璃棒 Mg(OH)2 CaCO3 取少量滤液2,加入盐酸酸化,再滴加少量BaCl2溶液,若无沉淀生成,则说明已沉淀完全 CO32-+2H+=CO2↑+H2O、H++OH-=H2O 蒸发结晶
【解析】
步骤①是过滤,除掉泥沙等难溶性杂质,再加入过量NaOH溶液、BaCl2溶液、Na2CO3除掉Mg2+、Ca2+、Fe3+、SO42-等杂质,过滤,经过步骤③后得NaCl溶液,可以通过蒸发浓缩、过滤的方法,得到NaCl晶体。
:(1)从框图可知,步骤①和②均实现了固液分离,故操作均为过滤;过滤用到的玻璃仪器有漏斗、烧杯、玻璃棒;故答案为:过滤;漏斗、烧杯、玻璃棒;
(2)粗盐提纯用到三种除杂试剂:NaOH溶液、BaCl2溶液和Na2CO3溶液,加入过量NaOH溶液,能将Mg2+、Fe3+沉淀为Mg(OH)2、Fe(OH)3,发生反应:Mg2++2OH-=Mg(OH)2↓ Fe3++3OH-=Fe(OH)3↓,加入过量的BaCl2溶液,能将SO42-沉淀为BaSO4,加入Na2CO3溶液能将Ca2+、Ba2+沉淀为CaCO3、BaCO3,故得到的沉淀有:Mg(OH)2、CaCO3、Fe(OH)3 、BaSO4 、BaCO3;故答案为:Mg(OH)2、CaCO3;
(3)如果SO42-沉淀完全,则向上层清液中加入少量BaCl2溶液,应无沉淀生成,否则,则沉淀不完全,故答案为:取少量滤液2,加入盐酸酸化,再滴加少量BaCl2溶液,若无沉淀生成,则说明已沉淀完全。
(4)经过步骤①和②后,溶液中有过量的NaOH和Na2CO3,可以通过加盐酸来除去:HCl+NaOH=H2O+NaCl、Na2CO3+2HCl=2NaCl+CO2↑+H2O,离子方程式为:H++OH-=H2O、CO32-+2H+=CO2↑+H2O,故答案为:H++OH-=H2O、CO32-+2H+=CO2↑+H2O;
(5)经过步骤③后得较纯净的NaCl溶液,通过蒸发结晶、过滤,即可得到NaCl晶体.故答案为:蒸发结晶。


科目:高中化学 来源: 题型:
【题目】用电解法处理含Cr2O72-的废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(SO4)3 | 否 | 否 | 加入30g | 否 | |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2O72-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2O72-的机理 |
A. 实验ⅱ与实验i对比,其他条件不变,增加c(H+)有利于Cr2O72-的去除
B. 实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于Cr2O72-的去除
C. 实验ⅳ中Fe2+循环利用提高了Cr2O72-的去除率
D. 若实验ⅳ中去除0.01 mol Cr2O72-,生成的阳离子全部转化成沉淀,则沉淀的质量是2.06g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于提纯或分离物质的方法有:A、萃取分液 B、加热分解 C、蒸发结晶 D、分液 E、蒸馏 F、过滤 G、渗析等,请将提纯或分离的序号填在后面横线上。
(1)分离饱和食盐水与泥沙的混合物___,
(2)精制Fe(OH)3胶体![]() 含有NaCl溶液
含有NaCl溶液![]() ___,
___,
(3)分离相溶的CCl4(沸点为76.75℃)和甲苯(110.6℃)的混合物___,
(4)从碘水里提取碘____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 向含0. 1 mol Na2SiO3的溶液中滴加盐酸,生成的H2SiO3胶体中胶粒的数目为0.1NA
B. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
C. 常温下,1L pH=10的氨水溶液中,发生电离的水分子数为1×10-10 NA
D. 7.8gNa2O2分别与过量的CO2和过量的SO2充分反应,转移的电子数目均为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数)
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1mol氦气含有的原子数为NA
C.71gCl2所含原子数为 NA
D.23g钠在化学反应中失去电子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol·L-1的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。
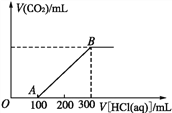
(1)OA段、AB段发生反应的离子方程式为_________________、__________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用气相还原法制备纳米级Fe,其流程如图所示:
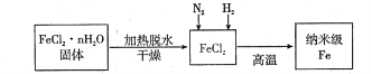
(1)纳米级Fe和稀盐酸反应的离子方程式为__________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒压绝热容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
A. 达到化学平衡状态时,v正(O2)=2v逆(SO2)
B. 容器内的压强不再变化说明反应达到化学平衡状态
C. 加入0.2 mol SO2和0.1 mol O2,充分反应后放出热量19.7kJ
D. 向容器中充入二氧化硫,正反应速率增大,逆反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com