
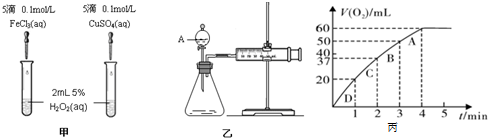
分析 (1)比较反应速率的大小可通过生成气泡的快慢来判断,比较金属阳离子的催化效果要排斥阴离子的干扰;
(2)收集的气体的体积相同,若比较反应速率快慢,需要知道生成40mL气体所需的时间;
(3)①根据图象确定生成氧气的体积;
②根据图象确定反应需要的时间;
③根据氧气的量计算双氧水的物质的量,再根据c=$\frac{n}{V}$计算双氧水的物质的量浓度;
④根据v=$\frac{△c}{△t}$比较A、B、C、D各点反应速率快慢;
⑤物质的浓度与反应速率成正比,浓度减小,反应速率减小.
解答 解:(1)如图甲可通过观察产生气泡的快慢,定性比较得出催化剂的催化效果;催化剂能改变化学反应的速率,这里是加快速率,若图1所示实验中反应速率为①>②,则一定说明氯化铁比硫酸铜催化效果好,因二者所含的阴离子不同,要证明Fe3+比Cu2+对H2O2分解催化效果好,还要使选择的试剂中阴离子种类相同,所以得出Fe3+和Cu2+对H2O2分解的催化效果,所以其结论不合理,
故答案为:产生气泡的快慢;不合理; 阴离子种类不同;
(2)如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,如果比较反应速率快慢,则实验中需要测量的数据为:产生40mL气体所需的时间,反应时间越短,则反应速率越快,
故答案为:产生40mL气体所需的时间;
(3)①根据图象知,第4分钟时,随着时间的推移,气体体积不变,所以实验时放出气体的总体积是60 mL,故答案为:60;
②放出 $\frac{1}{3}$气体体积是60 mL×$\frac{1}{2}$=20mL,根据图象知,需要的时间是1min,故答案为:1;
③设双氧水的物质的量为x,
2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
2mol 22.4L
x 0.06L
x=$\frac{2mol×0.06L}{22.4L}$=0.0054mol,
所以其物质的量浓度=$\frac{0.0054mol}{0.05L}$=0.11 mol•L-1,
故答案为:0.11 mol•L-1;
④根据图象结合v=$\frac{△c}{△t}$知,A、B、C、D各点反应速率快慢的顺序为:D>C>B>A,
故答案为:D>C>B>A;
⑤反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小,
故答案为:随着反应的进行,浓度减小,反应速率减慢.
点评 本题考查探究催化剂、浓度等对反应速率的影响的实验方案设计,试题涉及的题量稍大,根据v=$\frac{△c}{△t}$来设计实验,通过得到气体的体积和时间的关系确定影响反应速率的因素,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
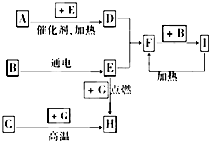 下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C. H可用作工业上冶炼金属的还原剂.请按要求填空:
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C. H可用作工业上冶炼金属的还原剂.请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| NaCl | MgCl2 | CaCl2 | SiCl4 | |
| 熔点(℃) | 801 | 712 | 782 | -68 |
| 沸点(℃) | 1 465 | 1 412 | 1 600 | 57.6 |
| A. | 仅① | B. | 仅② | C. | ①②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
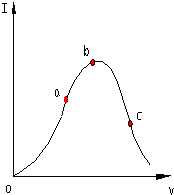 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
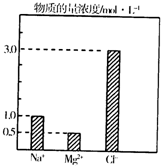 金属及其化合物有广泛的应用.
金属及其化合物有广泛的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com