
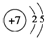 ;
; ;
;分析 A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期,则A、B处于第二周期,C、D、E处于第三周期;C、B可按原子个数比2:1和1:1分别形成两种化合物甲和乙,则C为Na,B为O;E是地壳中含量最高的金属元素,则E为Al;D、A按原子个数比3:2形成化合物丙,则D为Mg、A为N元素,据此解答.
解答 解:A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期,则A、B处于第二周期,C、D、E处于第三周期;C、B可按原子个数比2:1和1:1分别形成两种化合物甲和乙,则C为Na,B为O;E是地壳中含量最高的金属元素,则E为Al;D、A按原子个数比3:2形成化合物丙,则D为Mg、A为N元素.
(1)E为Al元素,在周期表中的位置是:第三周ⅢA族,故答案为:第三周ⅢA族;
(2)A为N元素,原子结构示意图为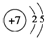 ,故答案为:
,故答案为: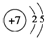 ;
;
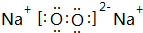
(3)乙为Na2O2,电子式为: ,故答案为:
,故答案为: ;
;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:Na+>Mg2+>Al3+,故答案为:Na+>Mg2+>Al3+.
点评 本题考查元素位置结构性质的综合应用,题目难度中等,注意正确推断元素的种类为解答该题的关键,本题注意掌握常用化学用语书写与微粒半径比较.


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | ①滴加稀HNO3 ②滴加BaCl2溶液 | 无明显现象 白色沉淀 | 原溶液一定含Ag+ |
| B | 滴加稀盐酸 | 有大量气泡产生 | 原溶液一定含CO32- |
| C | ①滴加稀HCl ②滴加AgNO3溶液 | 无明显现象 白色沉淀 | 原溶液一定含Cl- |
| D | ①加KSCN溶液 ②滴加氯水 | 无明显现象 溶液呈红色 | 原溶液一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片接电源的正极 | |
| B. | 铜片上发生的反应是:Ag++e-═Ag | |
| C. | 银片上发生的反应是:4OH--4e-═O2↑+2H2O | |
| D. | 需用硫酸铜溶液为电镀液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)=CH3OH(g)△H1=akJ/mol | 2.5 | 0.2 |
| ②H2(g)+CO2(g)=CO(g)+H2O(g)△H2=bkJ/mol | 1.0 | 2.3 |
| ③3H2(g)+CO2(g)=CH3OH(g)+H2O(g)△H3 | K3 | 4.6 |
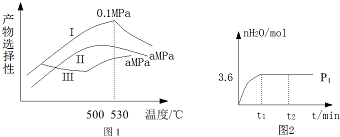
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
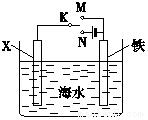 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO3 | B. | FeCl2 | C. | NaHSO3 | D. | AgNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com