
分析 (1)①醋酸钠溶液中醋酸根离子水解显碱性,②氯化铵溶液中铵根离子水解溶液显酸性;
(2)醋酸钠溶液醋酸根离子结合水电离出的氢离子生成醋酸,促进水的电离溶液中氢氧根离子浓度增大,溶液显碱性;
(3)a.②氯化铵溶液中铵根离子水解溶液显酸性,促进水的电离;
b.②氯化铵溶液中铵根离子水解溶液显酸性,NH4++H2O?NH3•H2O+H+,常温下水电离出的c(OH-)=c(H+)=1.0×10-7mol/L,由水电离出的c(H+)>1.0×10-7mol/L;
c.若两溶液等体积混合后pH=7,c(OH-)=c(H+),依据溶液中离子存在的电荷守恒关系为c(NH4+)+c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-)计算判断;
(4)惰性电极电解溶液醋酸钠溶液,在电解池的阴极上是溶液中阳离子得电子发生还原反应;
解答 解:(1)25℃时,现有浓度均为0.10mol/L的2种溶液:①醋酸钠溶液醋酸根离子结合水电离出的氢离子生成醋酸,促进水电离平衡正向进行,溶液中氢氧根离子浓度增大,溶液水解显碱性,CH3COO-+H2O?CH3COOH+OH-,溶液中c(OH-)>c(H+);
②氯化铵溶液中铵根离子水解结合水电离出的氢氧根离子,促进水的电离平衡正向进行,溶液显酸性,NH4++H2O?NH3•H2O+H+,溶液中c(OH-)<c(H+),
故答案为:①;
(2)①醋酸钠溶液醋酸根离子结合水电离出的氢离子生成醋酸,促进水电离平衡正向进行,溶液中氢氧根离子浓度增大,溶液水解显碱性,CH3COO-+H2O?CH3COOH+OH-,
故答案为:CH3COO-+H2O?CH3COOH+OH-;
(3)a.②氯化铵溶液中铵根离子水解溶液显酸性,NH4++H2O?NH3•H2O+H+,是盐的水解促进水的电离,故a错误;
b.常温下水电离出的c(OH-)=c(H+)=1.0×10-7mol/L,②氯化铵溶液中铵根离子水解溶液显酸性,NH4++H2O?NH3•H2O+H+,铵根离子水解促进了水的电离平衡正向进行,得到由水电离出的c(H+)>1.0×10-7mol/L,故b正确;
c.若两溶液等体积混合后pH=7,c(OH-)=c(H+),依据溶液中离子存在的电荷守恒关系为c(NH4+)+c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-)计算得到c(NH4+)+c(Na+)=c(Cl-)+c(CH3COO-),故c正确,
故答案为:bc;
(4)在电解池的阴极上是阳离子得电子的还原反应,醋酸钠溶液中氢离子在阴极得到电子发生还原反应生成氢气,电极反应为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑.
点评 本题涉及弱电解质的电离以及盐的水解等方面的知识,溶液中电荷守恒,影响水的电离平衡因素的分析判断,注意知识的归纳和梳理是解题的关键,题目难度中等.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
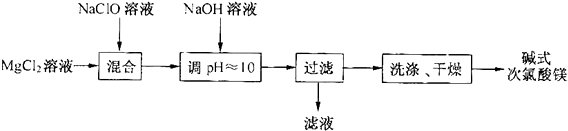
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
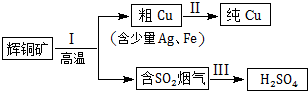
| 所含离子 | Na+ | HCO3- | CO32- | SO32- | HSO3- |
| 浓度mol/L | 0.005 | 0.01 | 0.05 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Br2+6KOH═5KBr+KBrO3+3H2O | |
| B. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+2H2O+Cl2↑ | |
| C. | 2KNO3 $\frac{\underline{\;\;△\;\;}}{\;}$ 2KNO2+O2↑ | |
| D. | NH4NO3 $\frac{\underline{\;\;△\;\;}}{\;}$ N2O↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 1.0mol/L Na2CO3溶液:c(H2CO3)+c(HCO3-)+c(CO32-)+C(Na+)=3.0mol/L | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 B
B C
C
 的邻位异构体分子内脱水的反应方程式
的邻位异构体分子内脱水的反应方程式 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.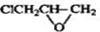 ,写出由D生成M的化学反应方程式
,写出由D生成M的化学反应方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H | B. | F | C. | Na | D. | Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com