
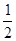 O2(g)==H2O(g) △H= -245kJ/mol
O2(g)==H2O(g) △H= -245kJ/mol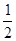 O2(g)==H2O(g) △H= -245kJ/mol。
O2(g)==H2O(g) △H= -245kJ/mol。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是
2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是| A.2Q2=Q1=92.4 | B.Ql<Q2<92.4 | C.Q2<Q1<92.4 | D.Ql=Q2<92.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
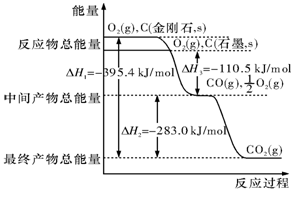
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2H2 ( g ) + O2 ( g ) = 2H2O ( l )△H = -484kJ/mol |
| B.H2 ( g ) + 1/2O2 ( g ) = H2O ( g )△H = +242kJ/mol |
| C.2H2+ O2 ="==" 2H2O△H = -484kJ/mol |
| D.H2O ( g ) = H2 ( g ) + 1/2O2 ( g )△H = +242kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-y kJ·mol-1 | B.-(5x-0.5y)kJ·mol-1 |
| C.-(10x-y)kJ·mol-1 | D.(10x-y)kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢气与氧气反应放出483.6kJ 热量 |
| B.氢气与氧气反应生成1mol 水蒸气时放出483.6kJ 热量 |
| C.2个H2分子燃烧生成水蒸气放出483.6kJ |
| D.2molH2与1molO2生成2mol水蒸气放出483.6kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应ΔH1>ΔH2 |
| B.由C(石墨)→C(金刚石);ΔH=+1.9KJ/mol ,可知1 mol石墨的总键能比1 mol金刚石的总键能大1.9 kJ,即金刚石比石墨稳定 |
| C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol |
| D.放热及熵增加的反应,一定能自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(l) ΔH=-867 kJ·mol-1 |
| B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移电子3.2 mol |
| C.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ |
| D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子3.2 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.2H2(g)+O2(g)===2H2O(l) ΔH1 |
| B.C(s)+O2(g)===CO(g) ΔH2 |
| C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3 |
| D.C(s)+O2(g)===CO2(g) ΔH4 |
| 化学键 | P—P | P—O | O===O | P===O |
| 键能kJ/mol | 197 | 360 | 499 | x |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com