
【题目】根据元素周期表和元素周期律,下列叙述正确的是( )
A.在周期表金属与非金属分界处寻找用于研制新农药的元素
B.H2、D2、T2互为同位素
C.如图所示实验可证明元素的非金属性:Cl>C>Si

D.用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图1。已知200 ℃时:
反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ/mol
反应Ⅱ:N2H4(g)+H2(g)=2NH3(g) ΔH2=-41.8 kJ/mol
下列说法不正确的是( )

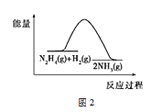
A.图1所示过程①是放热反应,②是吸热反应
B.反应Ⅱ的能量过程示意图如图2所示
C.断开3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为:N2H4(g)= N2(g)+2H2(g) ΔH=-50.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M可用于消毒剂、抗氧化剂、医药中间体。实验室由芳香烃A制备M的一种合成路线如下:
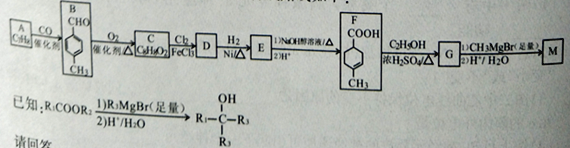
请回答:
(1)B的化学名称为___________;D中官能团的名称为______________________。
(2)由F生成G的反应类型为___________;F的分子式为___________。
(3)由E转化为F的第一步反应的化学方程式为______________________。
(4)M的结构简式为___________。
(5)芳香化合物Q为C的同分异构体,Q能发生银镜反应,其核磁共振氢谱有4组吸收峰。写出符合要求的Q的一种结构简式______________________。
(6)参照上述合成路线和信息,以苯甲酸乙酯和CH3MgBr为原料(无机试剂任选),设计制备 的合成路线_________________________________。
的合成路线_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用环己醇制备环己酮,使用的氧化剂可以是次氯酸钠、重铬酸钾等。

已知:环己醇沸点:160.8℃,微溶于水;
环己酮沸点:155.6℃,微溶于水;
醋酸沸点117.9℃,和水以任意比例互溶。
下列装置分别是产品的合成装置和精制装置示意图:

合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2mL环己醇和25mL冰醋酸。开动搅拌器,将40mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5min。然后,在室温下继续搅拌30min后,在合成装置中再加入30mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。回答下列问题:
(1)在合成装置中,甲装置的名称是_____________。
(2)三颈烧瓶的容量为_____________(填“50mL"、“100mL”或“250mL")。
(3)滴液漏斗具有特殊的结构,主要目的是_____________。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是_____________。然后加入精制食盐使之变成饱和溶液,将混合液倒入_____________中,分离得到有机层。
(5)用如图对粗产品进行精制,蒸馏收集_____________℃的馏分。
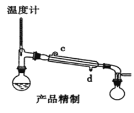
(6)检验环己酮是否纯净,可使用的试剂为_____________。
A.重铬酸钾溶液B.金属钠C.新制的氢氧化铜悬浊液D.醋酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.铅蓄电池放电时的负极和正极的质量均增加
B.CaCO3(s)=CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的△H>0
C.对于发应2H2O2![]() 2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
D.H2O与金属Na反应生成1molH2,反应中转移的电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是( )
A.铜的电解精炼中,若阳极质量减少32g,则转移电子的电子数为6.02×1023
B.吸热反应发生过程中要不断从外界获得能量,放热反应一定不需要吸收外界能量
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)ΔH=-285.8kJ/mol
D.已知稀溶液中:H+(aq)+OH-(aq)=H2O(l)ΔH=-53.7kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于53.7kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥运会禁止运动员使用兴奋剂.以下两种兴奋剂的结构分别为:
①利尿酸 ②兴奋剂X
②兴奋剂X
则关于它们的说法中正确的是( )
A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱中共有六个峰
B.1mol兴奋剂X与足量浓溴水反应,最多消耗4molBr2
C.两种兴奋剂均属于芳香烃
D.两种分子中的所有原子均可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )

A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)=CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
(1)比较此时正、逆反应速率的大小:v(正)____v(逆)(填“>”“<”或“=”)。
(2)若加入CH3OH后,经10min反应达到平衡,此时CH3OH的转化率__ ,该时间内反应速率v(CH3OH)=____ mol·L-1·min-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com