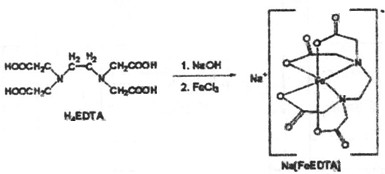
将6.4g 铜加入到50mL a mol/L的硝酸溶液中,铜全部溶解,得到NO2和NO的混合气体.将反应后溶液稀释至100mL,测得NO3-的浓度为3mol/L.
(1)混合气体中NO2和NO的总物质的量为 mol(用含a的式子表示).
(2)稀释后的溶液中H+的物质的量浓度为 mol/L.
(3)若a=9,则混合气体中NO2的物质的量为 mol.
【答案】
分析:(1)由氮原子守恒可知,混合气体中NO
2和NO的总物质的量等于原硝酸的物质的量-反应后溶液中NO
3-的物质的量;
(2)铜全部溶解,利用n=
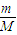
来计算铜的物质的量,由反应后溶液稀释至100mL,测得NO
3-的浓度为3mol/L及电荷守恒来计算H
+的物质的量浓度;
(3)利用电子守恒来计算.
解答:解:(1)硝酸的物质的量为0.05L×amol/L=0.05amol,
反应后溶液中NO
3-的物质的量为0.1L×3mol/L=0.3mol,
则由氮原子守恒可知,
混合气体中NO
2和NO的总物质的量为0.05amol-0.3mol=(0.05a-0.3)mol,
故答案为:(0.05a-0.3);
(2)Cu的物质的量为

=0.1mol,
将反应后溶液稀释至100mL,测得NO
3-的浓度为3mol/L,
则铜离子的浓度为

=1mol/L,
设稀释后的溶液中H
+的物质的量浓度为x,由电荷守恒可知,
1mol/L×2+x=3mol/L×1,解得x=1mol/L,
故答案为:1;
(3)a=9,则混合气体中NO
2和NO的总物质的量为(0.05×9-0.3)mol=0.15mol,
设混合气体中NO
2的物质的量为m,NO的物质的量为(0.15mol-m),
由氧化还原反应中铜元素失去电子,氮元素得到电子,
根据电子守恒可知,
m×(5-4)+(0.15mol-m)×(5-2)=0.1mol×(2-0),
解得m=0.125mol,
故答案为:0.125.
点评:本题考查利用硝酸的化学性质及金属与硝酸反应中的原子守恒、电子守恒及溶液中的电荷守恒来进行计算,正确运用守恒法是解答本题的关键.

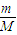 来计算铜的物质的量,由反应后溶液稀释至100mL,测得NO3-的浓度为3mol/L及电荷守恒来计算H+的物质的量浓度;
来计算铜的物质的量,由反应后溶液稀释至100mL,测得NO3-的浓度为3mol/L及电荷守恒来计算H+的物质的量浓度; =0.1mol,
=0.1mol, =1mol/L,
=1mol/L,