
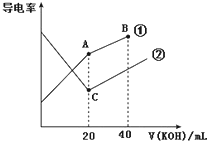
| A. | A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═0.1mol•L-1 | |
| B. | B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | C点水电离的c(OH-)大于A点水电离的c(OH-) | |
| D. | A、B、C三点溶液均有Kw=c(H+)•c(OH-)=1.0×10-14 |
分析 溶液电导率与离子浓度成正比,HCl是强电解质、醋酸是弱电解质,所以相同浓度的盐酸和醋酸,盐酸中离子浓度大于醋酸,则相同浓度的盐酸和醋酸,盐酸电导率较大,根据图象知,①是醋酸和KOH的混合、②是HCl和KOH的混合;
A.A点溶液中,醋酸和KOH恰好完全反应生成CH3COOK,溶液中存在电荷守恒,则c(CH3COO-)+c(OH-)-c(H+)═c(K+);
B.B点溶液中KOH过量,溶液中溶质为等物质的量浓度的CH3COOK和KOH,醋酸根离子水解生成OH-,但水解程度较小,溶液呈强碱性;
C.C点HCl和KOH恰好完全反应生成KCl,酸或碱抑制水电离,含有弱离子的盐促进水电离;
D.离子积常数只与温度有关,温度相同,离子积常数相同.
解答 解:溶液电导率与离子浓度成正比,HCl是强电解质、醋酸是弱电解质,所以相同浓度的盐酸和醋酸,盐酸中离子浓度大于醋酸,则相同浓度的盐酸和醋酸,盐酸电导率较大,根据图象知,①是醋酸和KOH的混合、②是HCl和KOH的混合;
A.A点溶液中,醋酸和KOH恰好完全反应生成CH3COOK,溶液中存在电荷守恒,则c(CH3COO-)+c(OH-)-c(H+)═c(K+),A点溶液体积增大一倍,则离子浓度降为原来的一半,所以c(CH3COO-)+c(OH-)-c(H+)═c(K+)=0.05mol/L,故A错误;
B.B点溶液中KOH过量,溶液中溶质为等物质的量浓度的CH3COOK和KOH,醋酸根离子水解生成OH-,但水解程度较小,溶液呈强碱性,则离子浓度大小顺序是c(K+)>c(OH-)>c(CH3COO-)>c(H+),故B正确;
C.C点HCl和KOH恰好完全反应生成KCl,酸或碱抑制水电离,含有弱离子的盐促进水电离,A的溶质为CH3COOK,促进水电离,C中溶质为KCl,既不促进也不抑制水电离,所以C点水电离的c(OH-)小于A点水电离的c(OH-),故C错误;
D.离子积常数只与温度有关,温度相同,离子积常数相同,酸碱中和反应是放热反应、弱电解质电离吸收热量、盐类水解吸收热量,所以A、B、C温度高低顺序是C>A>B,温度越高,水的离子积常数越大,所以离子积常数大小顺序是C>A>B,故D错误;
故选B.
点评 本题考查离子浓度大小比较、水的电离等知识点,为高频考点,明确溶液中溶质及其性质、离子积常数影响因素等知识点是解本题关键,注意A中溶液体积增大导致物质浓度降低,易忽略而导致错误,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
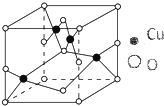 纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色.
纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn与稀硫酸反应制取H2时,加入蒸馏水 | |
| B. | Al在O2中燃烧生成Al2O3时,用铝粉替代铝片 | |
| C. | CaCO3与稀盐酸反应生成CO2时,适当升高温度 | |
| D. | 用KClO3固体分解制取O2时,固体中添加少量MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
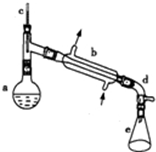 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
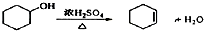 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•5H2O | B. | CuSO4 | C. | Cu(OH)2•6H2O | D. | Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
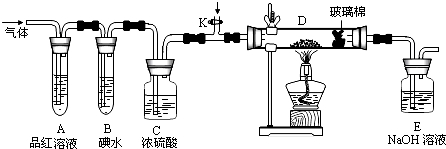
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com