
为达到相应的实验目的,下列实验的设计或操作最合理的是( )
A.为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值
B.为观察Mg条在CO2气体中的燃烧,在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部。
C.为比较HA和HB两种弱酸的Ka大小,可用pH计测定同温同浓度的NaA溶液和NaB 溶液的pH值
D.为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用甲基橙作指示剂,用标准盐酸溶液滴定
C
【解析】
试题分析:A、相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值只能得出HCl与H2S的酸性的强弱,不能判断Cl、S的非金属性的强弱,错误;B、二氧化碳的集气瓶底部应铺一层细砂,防止集气瓶底部被炸裂,错误;C、根据越弱越水解的原理,用pH计测定同温同浓度的NaA溶液和NaB 溶液的pH值,pH大的对应的酸越弱,正确;D、该滴定中不能只用甲基橙作指示剂,无论氢氧化钠是否变质,滴定终点的现象都是溶液由黄色变为橙色,且半分钟内不变色,所以应用酚酞、甲基橙同时做指示剂去滴定,先加入酚酞,红色褪去时,再加入甲基橙,若溶液由黄色变为橙色,证明氢氧化钠变质,错误,答案选C。
考点:考查对实验方案的评价


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:填空题
(6分)A、B、C、D、E、F六种原子序数依次增大的短周期元素。A与其余五种元素既不同周期,也不同主族;B、C、D、E、F五种元素分别位于五个相邻的主族,原子序数之和为54,其中B的单质为空气中的主要成分之一。
(1)A、B形成的化合物液态时可发生微弱电离,电离产生的阴离子的电子式为_______________。
(2)某含F的盐矿石的组成可以看作其氧化物中有1/4的F被E替换,再由D平衡其电荷形成的。该矿石的化学式为 。(用氧化物形式表示)
(3)工业中制备单质E的阳极电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
对于相同物质的量的SO2和SO3,下列说法中正确的是
A.硫元素的质量比为5:4 B.分子数之比为1:1
C.原子总数之比为4:3 D.质量之比为1:1
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:填空题
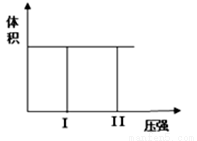
( I) 在一个容积固定不变的密闭容器中进行反应:
2X(g) + Y(g)  2Z(g) 若把2molX和1molY充入该容器时,处于状 态I, 反应在绝热条件下达到平衡时处于状态II(如下图),则该反应的△H 0; ( 填:“< ,> , = ”)。该反应在 (填:高温或低温)条件下能自发进行。
2Z(g) 若把2molX和1molY充入该容器时,处于状 态I, 反应在绝热条件下达到平衡时处于状态II(如下图),则该反应的△H 0; ( 填:“< ,> , = ”)。该反应在 (填:高温或低温)条件下能自发进行。
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,
pC(g) ,
在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如
下表
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式: 。
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,
A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa
和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。

查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g) 2XY3(g) △H=-92.6 kJ.mol-1
2XY3(g) △H=-92.6 kJ.mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | |||
① | 1 | 3 | 0 | 2分钟 | 放热46.3kJ |
② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
下列叙述不正确的是
A.容器①中反应从开始到刚达平衡时用XY3表示的反应速率为v(XY3)=1/30 moI.L-l·s-1
B.平衡时,两个容器中XY3的物质的量浓度相等
C.容器②中反应达到平衡时吸收的热量为Q
D.容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
已知:(1)Al(OH)3的电离方程式为:AlO2-+H++H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
(2)无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl-
(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:
PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb
则下列关于Al(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是 ( )
A.均为强电解质 B.均为弱电解质 C.均为离子化合物 D.均为共价化合物
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液由于浓度不同而能发生不同氧化还原反应的是( )
A.①③ B.③④ C.①② D.①③④
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:选择题
下列反应的离子方程式错误的是
A.向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3- +2OH- = CaCO3↓+2H2O+CO32-
B.氢氧化钡溶液与硫酸氢钠溶液1:1混合Ba2++ OH- +H+ +SO42- = BaSO4↓+H2O
C.氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3- == CaCO3↓+H2O
D.向溴化亚铁溶液中通入过量氯气:2Fe2+ + 4Br— + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl—
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三9月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法正确的是( )
A.电解精炼铜过程中,电路中每通过NA个电子,阳极溶解铜32 g
B.1 L 2 mol/L的NH4Cl溶液中含NH+4数目为2 NA
C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3 NA
D.1 mol C20H42的分子中含有的共价键数目为61 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com