
科目:高中化学 来源: 题型:选择题
| A. | 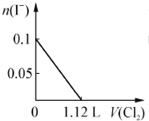 | B. | 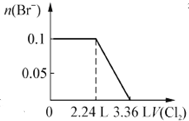 | ||
| C. | 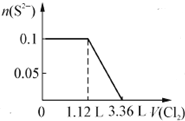 | D. | 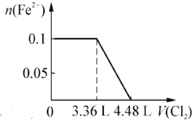 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能大小:S>P>Si | |
| B. | 电负性顺序:C<N<O<F | |
| C. | 因为晶格能CaO比KCl高,所以KCl比CaO熔点高 | |
| D. | SO2与CO2化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48gO2和O3含有的氧原子数均为3NA5.4g铝与足量NaOH反应转移的电子数为0.3NA | |
| B. | 12g重水(D2O)中含有的电子数为6 NA | |
| C. | 标准状况下,11.2L苯所含原子数为6NA | |
| D. | 160g胆矾溶于水形成1L溶液,溶液的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 操作 | 向AlCl3溶液中通入NH3 | 向NaHCO3溶液中滴加石灰水 | 向NaCO3溶液中滴加盐酸 | 向KBr溶液中滴加稀氯水 |
| X | Al(OH)3 | Na2CO3 | NaCl | Br2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已达平衡的反应C(s)+H2O(g)?CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动 | |
| B. | 已达平衡的反应N2(g)+3H2(g)?2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 | |
| C. | 改变外界条件使正反应速率大于逆反应速率时,化学平衡一定向正反应方向移动 | |
| D. | 已达平衡的反应N2(g)+3H2(g)?2NH3(g),在恒压反应器中充入稀有气体,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{125a}{9V}$mol/L | B. | $\frac{125a}{18V}$mol/L | C. | $\frac{125a}{36V}$mol/L | D. | $\frac{125a}{54V}$mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com