
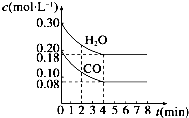
 800��ʱ�����Ϊ1L�����ܱ������У�ͨ��һ������CO��H2O��g����������Ӧ��CO��g��+H2O��g��?H2��g��+CO2��g��CO��H2O��g��Ũ�ȱ仯��ͼ��ʾ������˵����ȷ���ǣ�������
800��ʱ�����Ϊ1L�����ܱ������У�ͨ��һ������CO��H2O��g����������Ӧ��CO��g��+H2O��g��?H2��g��+CO2��g��CO��H2O��g��Ũ�ȱ仯��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | �����������ѹǿ���ٸı���Ӧ�ﵽƽ�� | |
| B�� | 4 min�������¶ȣ�CO��H2O��g��Ũ��Ҳ���ߣ����H��0 | |
| C�� | 800��ʱֻ�ı�CO��H2O��g����ʼͶ�ϣ��ֱ��ƽ�⣬CO��ת������H2O��g����ת����֮�Ͳ��� | |
| D�� | ����ʼ����0.30mol CO��0.10mol H2O��0.20mol CO2��20mol H2����Ӧ��������Ӧ������� |
���� A���������������ȣ������������ѹǿʼ�ղ��ٸı䣻
B��4 min�������¶ȣ�CO��H2O��g��Ũ��Ҳ���ߣ�ƽ�������ƶ����淴Ӧ�����ȷ�Ӧ��
C��800��ʱֻ�ı�CO��H2O��g����ʼͶ�ϣ��ֱ��ƽ�⣬�൱�ı�ѹǿ�����������������ȣ�
D����ͼ��֪��ƽ��ʱCO��Ũ��Ϊ0.08mol/L����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��mol/L����0.2 0.3 0 0
�仯��mol/L����0.12 0.12 0.12 0.12
�仯��mol/L����0.08 0.18 0.12 0.12
��ƽ�ⳣ��k=$\frac{0.12��0.12}{0.08��0.18}$=1������Qc��K����Դ�С��ȷ����Ӧ���еķ���
��� �⣺A���������������ȣ������������ѹǿʼ�ղ��ٸı䣬���Բ�����ƽ��״̬�ı�־����A����
B��4 min�������¶ȣ�CO��H2O��g��Ũ��Ҳ���ߣ�ƽ�������ƶ����淴Ӧ�����ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ�����H��0����B��ȷ��
C��800��ʱֻ�ı�CO��H2O��g����ʼͶ�ϣ��ֱ��ƽ�⣬�൱�ı�ѹǿ�����������������ȣ�����ƽ�ⲻ�ƶ�������CO��ת������H2O��g����ת����֮�Ͳ��䣬��C��ȷ��
D����ͼ��֪��ƽ��ʱCO��Ũ��Ϊ0.08mol/L����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��mol/L����0.2 0.3 0 0
�仯��mol/L����0.12 0.12 0.12 0.12
�仯��mol/L����0.08 0.18 0.12 0.12
��ƽ�ⳣ��k=$\frac{0.12��0.12}{0.08��0.18}$=1��Qc=$\frac{0.2��0.2}{0.3��0.1}$=1.33��K������ƽ�������ƶ�����D����
��ѡBC��
���� ���⿼��ѧƽ��״̬���жϺ��йؼ��㣬ע��ƽ�ⳣ����Ũ���̵Ĵ�С�ıȽ��жϷ�Ӧ���еķ����ǽ��Ĺؼ�����Ŀ�Ѷ��еȣ�


 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.8 mol | B�� | 2.6 mol | C�� | 1.4 mol | D�� | 0.8 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol K2SO4����ˮ��������Һ��K+����ĿΪNA | |
| B�� | ���³�ѹ�£�32g�����������ӵ���ĿΪNA | |
| C�� | ��״���£�22.4LH2O������ԭ�ӵ���ĿΪ2 NA | |
| D�� | 11.2L H2������ԭ�ӵ���ĿΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 150 mL | B�� | 200 mL | C�� | 250 mL | D�� | 280 mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 12g����NaHSO4�к��������ӵ�����Ϊ0.1NA | |
| B�� | 0.1mol Cl2ȫ������ˮ��ת�Ƶ��ӵ���ĿΪ0.1NA | |
| C�� | �����£�pH=2�Ĵ�����Һ�������е�H+��Ϊ0.01NA | |
| D�� | �ϳɰ���Ӧ��ƽ��ʱ��ÿ����3NA�����������������3NA������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �٢ۢ� | C�� | �ڢۢ� | D�� | �٢ۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 40mL | B�� | 72mL | C�� | 128mL | D�� | 20mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
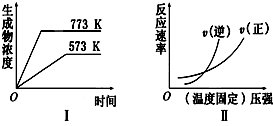
| A�� | 2SO3��g��?2SO2��g��+O2��g����H��0 | B�� | N2��g��+3H2��g��?2NH3��g����H��0 | ||
| C�� | 4NH3��g��+5O2��g��?4NO��g��+6H2O��g����H��0 | D�� | H2��g��+CO��g��?C��s��+H2O��g����H��0 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com