
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、CuO、HClO、Cu | |
| B. | 水玻璃、Na2O、CaO•6SiO2、AgO、SO3 | |
| C. | KAl (SO4) 2•12H2O、KCIO3、NH3•H2O、CH3CH2OH | |
| D. | 普通玻璃、H2O、Fe (SCN) 3、葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si与SiO2在常温下都可与NaOH溶液反应 | |
| B. | C与SiO2之间可以反应制备Si,同时得到CO | |
| C. | Si与SiO2都可以与氢氟酸反应 | |
| D. | Si→SiO2→H2SiO3可以通过一步反应实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与互为石墨同分异构体 | |
| B. | 石墨比金刚石稳定 | |
| C. | 浓硫酸与稀氢氧化钠溶液反应的中和热为-57.3kJ | |
| D. | 稀硫酸和稀Ba(OH)2溶液反应生成1molH2O时的热效应是-57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 283.0kJ/mol | B. | -566.0kJ/mol | C. | 283.0kJ | D. | 566.0kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
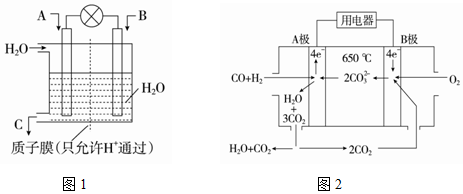
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com