
【题目】下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是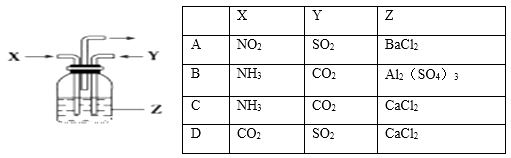
A.A
B.B
C.C
D.D
【答案】D
【解析】A 、SO2溶于水生成H2SO3,具有还原性,NO2溶于水生成HNO3具有氧化性,HNO3能将H2SO3氧化成H2SO4,再与BaCl2反应生成沉淀,所以A中有沉淀生成,A不符合题意。
B 、氨气溶于水生成氨水呈碱性,能与Al3+反应生成Al(OH)3沉淀,所以B中有沉淀生成,B不符合题意。
C、氨气溶于水生成氨水呈碱性,CO2与碱反应生成CO32-,然后与Ca2+反应生成CaCO3沉淀,C不符合题意。
D、CO2、SO2溶于水溶液均呈酸性,与CaCl2均不反应,无沉淀生成,D符合题意。
所以答案是:D
【考点精析】利用氨的化学性质对题目进行判断即可得到答案,需要熟知与水反应,NH3是惟一能使润湿的红色石蕊试纸交蓝的气体,常用此性质检验NH3;与酸反应:NH3+HCl=NH4Cl(生成白烟);与O2反应:4NH3+5O2=4NO+6H2O+Q;


科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,某气体A的密度是1.25 g·L-1,则它的摩尔质量是________;该气体在相同温度和压强下其相对于氢气的密度是______。若该气体是单质,同质量的A与氧气所含的分子数之比为_______________。
(2)某物质的相对分子质量为M,在温度为T时的溶解度为S g,此时测得饱和溶液的密度为d g·cm-3,则该饱和溶液中该物质的物质的量浓度为_______(用代数式表示)。
(3)现实验室要用质量分数为40%的浓氢氧化钠(密度为1.2 g·mL-1)来配制浓度为0.6 mol·L-1的稀氢氧化钠100 mL,问需要这种浓碱的体积是______ mL。
(4)下列有关实验操作或判断不正确的是________。
A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大
B.用干燥的pH试纸测定氯水的pH
C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸并搅拌
D.观察钾元素焰色反应的操作:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
E.制备氢氧化亚铁时,将盛有NaOH溶液的滴管,伸入硫酸亚铁溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。

(1)海水中所得粗盐中含Ca2+、Mg2+、SO42-等杂质,为了得到精盐,下列试剂加入的先后顺序正确的是_______
A. BaCl2→Na2CO3→NaOH→HCl B. NaOH→BaCl2→Na2CO3→HCl
C. Na2CO3→NaOH→BaCl2→HCl D. BaCl2→NaOH→Na2CO3→HCl
(2)为了检验精盐中是否含有SO42-,正确的方法是____________________________。
(3)写出电解饱和NaCl溶液的化学方程式____________________________________。
Ⅱ.海藻中提取碘的流程如图:

(4)指出提取碘的过程中有关实验操作名称:①__________,③___________;
(5)步骤②反应的离子方程式为_______________________________。
(6)下列关于海藻提取碘的说法,正确的是_____________
A.海藻的灼烧可以在蒸发皿中进行
B.含碘的有机溶液呈现出紫红色
C.操作③中先放出下层液体,然后再从下口放出上层液体
D.蒸馏操作时,温度计的水银球应伸入液面以下但不能触碰到蒸馏烧瓶的底部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,将xmL pH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应.下列关于反应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐. 该小组同学利用如图装置进行实验.
①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊.
②取少量加热后生成的黑色固体于试管中,加入稀硫酸.观察到黑色固体逐渐溶解,溶液变成蓝色.
③取少量上述蓝色溶液加入试管中,浸入一根洁净的铁丝.观察到铁丝表面有红色物质析出.
请回答下列问题:
(1)绿色固体中含有的元素是 .
(2)加热后试管中剩余的黑色物质是 .
(3)假设该绿色物质是一种纯净物,则其化学式可能是 , 加热分解的化学方程式为 .
(4)上述实验步骤③中的反应的离子方程式为 .
(5)实验装置最后的干燥管的作用是 .
(6)如果将B、C两装置对调,能否达到实验目的? , 为什么? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名的医学家宋慈《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是:4Ag + 2H2S + O2![]() 2X(黑色)+ 2H2O,下列说法中,不正确的是
2X(黑色)+ 2H2O,下列说法中,不正确的是
A. 银针验毒时,空气中的氧气得到电子
B. 每生成1molX,反应转移2mole-
C. 氧化剂和还原剂的物质的量之比为1: 4
D. 反应中Ag和H2S均为还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢化钾(KH)属于离子化合物,KH跟水反应可以放出氢气.下列说法中正确的是( )
A.KH的水溶液呈碱性
B.KH中氢离子可以被还原为氢气
C.KH是一种强氧化剂
D.KH中的氢离子是裸露的质子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:

回答下列问题:
(1)写出所含物质的化学式:固体B_____,沉淀D_____。
(2)写出①、④两个反应的化学方程式:
①_______________________________________
④_______________________________________
(3)写出②、③两个反应的离子方程式:
②_______________________________________
③_____________________________________
(4)设计实验检验溶液F中所含溶质的阳离子:___________________________。
(5)分别写出Al2O3和Fe2O3在工业上的一种主要用途:
Al2O3︰_____________________________________
Fe2O3︰_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=﹣lgc(M),p(CO32﹣)=﹣lgc(CO32﹣).下列说法正确的是( ) 
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)>c(CO32﹣)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32﹣)
D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com