
| A. | 碳碳键键长:乙烯>苯 | B. | 密度:一氯乙烷>一氯丁烷 | ||
| C. | 热稳定性:NaHCO3>Na2CO3>H2CO3 | D. | 沸点:H2O>H2S>H2Se |
分析 A.苯中的碳碳键介于单键与双键之间;
B.氯代烃中C原子质量分数越多,密度越大;
C.碳酸钠加热不分解,碳酸氢钠加热分解,碳酸常温下分解;
D.水中含氢键,同类型分子相对分子质量大的沸点高.
解答 解:A.苯中的碳碳键介于单键与双键之间,则碳碳键键长:乙烯<苯,故A错误;
B.氯代烃中C原子质量分数越多,密度越大,则密度:一氯乙烷>一氯丁烷,故B正确;
C.碳酸钠加热不分解,碳酸氢钠加热分解,碳酸常温下分解,则稳定性为热稳定性:Na2CO3>NaHCO3>H2CO3,故C错误;
D.水中含氢键,同类型分子相对分子质量大的沸点高,则沸点为H2O>H2Se>H2S,故D错误;
故选B.
点评 本题考查物质性质及微粒性质比较,为高考常见题型,侧重于学生的分析能力、应用能力的考查,把握性质比较的方法和角度为解答该类题目的关键,注意规律性知识的应用,题目难度不大.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题
 ,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
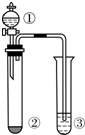 下表所列实验探究,利用如图所示实验装置,能得出相应实验结论的是( )
下表所列实验探究,利用如图所示实验装置,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 水 | 电石 | CuSO4溶液 | 乙炔具有还原性 |
| B | 浓硝酸 | Cu | KI-淀粉溶液 | 氧化性:NO2>KI |
| C | 浓盐酸 | KMnO4 | KI-淀粉溶液 | 氧化性:KMnO4>Cl2>I2 |
| D | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | 溶解度:AgCl>Ag2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.铝热反应 | B.燃料燃烧 | C.酸碱中和反应 | D.Ba(OH)2•8H2O与NH4Cl固体混合 |
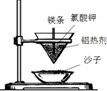 |  | 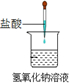 | 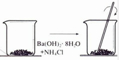 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 8:1 | B. | 2:1 | C. | 3:2 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验操作 | 实验现象与结论 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com