
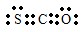 .
.分析 (1)羰基硫(COS)中碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,根据羰基硫分子中所有原子的最外层都满足8电子结构书写其电子式;(2)根据化学键断裂要吸收热量,形成化学键要放出热量,分别计算后进行比较确定放热、吸热以及反应热的数值,据此结合热化学方程式的书写方法书写热化学方程式;(3)氯化铁具有氧化性,能与二氧化硫发生氧化还原反应生成硫酸根离子,再与钡离子反应生成硫酸钡沉淀,以此来解答;
(4)已变质和未变质的NaClO2与Fe2+反应都生成Cl-,根据转移电子守恒判断.
解答 解:(1)羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为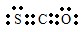 ,
,
故答案为: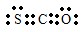 ;
;
(2)1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,N4气体转变为N2的热化学方程式为:N4(g)?2N2(g) △H=-882KJ/mol,
故答案为:N4(g)?2N2(g) △H=-882KJ/mol;
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,
发生2Fe3++SO2+2H2O═SO42-+4H++2Fe2+,
SO42-+Ba2+═BaSO4↓,
故答案为:BaSO4;
(4)Fe2+与变质前后的NaClO2反应,最后的还原产物都是NaCl,根据电子守恒消耗的Fe2+物质的量应相同,
故答案为:相同.
点评 本题考查较为综合,涉及电子式、热化学方程式书写、氧化还原等知识,综合考查学生的双基,有利于培养学生的科学素养,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 用BaCl2溶液鉴别SO42- 和 SO32- | |
| B. | 用浓HNO3与Cu 反应制备NO2 | |
| C. | 用特殊方法把固体物质加工到纳米级(1nm-100nm) 的超细粉末粒子,制得纳米材料,纳米材料也是一种胶体 | |
| D. | 将混有HCl的Cl2通入饱和NaCl溶液中除去HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常温下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物民其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.
短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常温下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物民其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 | |
| B. | 乙醇依次通过消去、取代、加成反应可生成乙二醇 | |
| C. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| D. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2不再化合 | |
| B. | N2、H2、NH3的质量相等 | |
| C. | N2、H2、NH3浓度不再变化 | |
| D. | 改变条件,N2、H2、NH3的浓度也不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
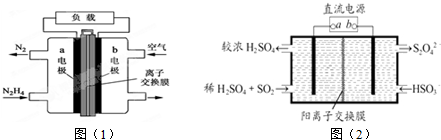
| A. | 图(1)中的a电极应与 图(2)的a相连 | |
| B. | 图(1)中a电极应的反应方程式为:N2H4+4OH--4e-═N2+4H2O | |
| C. | 用该燃料电池作为装置图(2)的直流电,吸收1 molSO2至少需要通人 0.5 mol N2H4 | |
| D. | 图(1)中OH-由阴离子交换膜从左流向右,图(2)中H+由阳离子交换膜从右流向左 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学犍 | O=O | C=0 | C≡O |
| 键能(kJ/mol) | 497 | 803 | 1072 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈电中性,胶体带有电荷 | |
| B. | 溶液中溶质粒子一定不带电,胶体中分散质粒子带有电荷 | |
| C. | 溶液中溶质粒子的运动有规律,而胶体粒子的运动无规律 | |
| D. | 溶液中通过一束光线时无特殊现象,胶体中通过一束光线时有明显的光带 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com