
(13分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: _______________________________
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图,标出正、负极及材料、电解质溶液并写出电极反应式。

正极反应____________________________;
负极反应____________________________。
(3)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答下列问题:
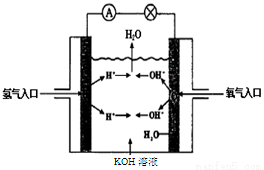
①负极反应式为  溶液PH (填“增大”、“不变”或“减小”)。
溶液PH (填“增大”、“不变”或“减小”)。
②该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2  2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑
反应Ⅰ中的还原剂是 ,7 gLi可吸收标况下H2 L,此时转移电子 moL。
(1)2Fe3+ + Cu = 2Fe2+ + Cu2+
(2)2Fe3+ + 2e- = 2Fe2+ ;Cu - 2e- = Cu2+ 
(3)①2H2 - 4e- + 4OH— = 4H2O;减小 ②Li;11.2;1
【解析】
试题分析:(1)FeCl3溶液腐蚀印刷电路铜板的离子方程式是2Fe3+ + Cu = 2Fe2+ + Cu2+(2)若将(1)中的反应设计成原电池,则Cu作负极,活动性比Cu弱的金属或石墨作正极,含有Fe3+离子的溶液作电解质溶液,装置图是 ;正极反应是2Fe3+ + 2e- = 2Fe2+ ;负极反应是Cu - 2e- = Cu2+;(3)①在氢氧燃料电池中,通入燃料的电极是负极,负极反应式为2H2 - 4e- + 4OH— = 4H2O;通入氧气的电极是正极,正极的电极反应式是:O2 + 4e- + 2H2O = 4OH— ;由于不断消耗氢氧根离子,所以溶液的pH逐渐减小;②在反应Ⅰ中的还原剂是Li;7 gLi的物质的量是1mol,根据反应方程式可知反应消耗0.5mol的氢气,其在标况下的体积是11.2L。由于Li是+1价的金属,所以此时转移电子是1mol。
;正极反应是2Fe3+ + 2e- = 2Fe2+ ;负极反应是Cu - 2e- = Cu2+;(3)①在氢氧燃料电池中,通入燃料的电极是负极,负极反应式为2H2 - 4e- + 4OH— = 4H2O;通入氧气的电极是正极,正极的电极反应式是:O2 + 4e- + 2H2O = 4OH— ;由于不断消耗氢氧根离子,所以溶液的pH逐渐减小;②在反应Ⅰ中的还原剂是Li;7 gLi的物质的量是1mol,根据反应方程式可知反应消耗0.5mol的氢气,其在标况下的体积是11.2L。由于Li是+1价的金属,所以此时转移电子是1mol。
考点:考查原电池的反应原理、电极反应式的书写及电子转移的知识。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源:2013-2014黑龙江省双鸭山市高一下学期期末考试化学试卷(解析版) 题型:选择题
恒温恒容的容器内,不可作为可逆反应I2(g)+H2(g) 2HI(g)达到平衡状态的标志的是
2HI(g)达到平衡状态的标志的是
A.1 mol H—H键断裂,同时有2 mol H—I键断裂 B.容器内气体的总压强不再变化
C.H2的物质的量浓度不再变化 D.混合气体的颜色不再变化
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西西安铁一中、铁一中国际合作校高三五月月考化学试卷(解析版) 题型:选择题
(5分)将一块金属钠投入到100ml MgCl2和AlCl3的混合溶液中,发现沉淀先多后少。反应完毕后收集到13.44L气体(标准状态),同时得到21.4g白色沉淀,将此沉淀溶于过量的NaOH溶液中,充分反应后沉淀质量减轻了15.6g。求原溶液中Mg2+、Al3+、Cl-的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西西安铁一中、铁一中国际合作校高三五月月考化学试卷(解析版) 题型:选择题
设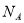 表示阿伏加德罗常数,下列叙述中正确的是
表示阿伏加德罗常数,下列叙述中正确的是
①.31g白磷含有的P—P键数为NA
②. 1mol CH3+(碳正离子)中含有电子数为10NA
③. 1mol铜与足量硫蒸气反应,转移电子数为2NA
④.1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2NA个电子
⑤.用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA
⑥.0.84 g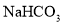 晶体中阳离子和阴离子总数为0.03NA
晶体中阳离子和阴离子总数为0.03NA
⑦.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA
⑧.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
⑨.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023
⑩.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
A ②④⑦⑧ B ③④⑥⑦⑧ C ④⑦ D④⑥⑨⑩
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西西安铁一中、铁一中国际合作校高三五月月考化学试卷(解析版) 题型:选择题
下列有关物质分类或归类正确的是
①混合物:石炭酸、福尔马林、水玻璃、水银 ②化合物:CaCl2、烧碱、聚苯乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡 ④同系物: CH2O2、C2H4O2、C3H6O2、C4H8O2
⑤有机物:酒精、 油脂、蔗糖、蛋白质
A.①③④ B.②④ C.②③④ D.③⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省高一第二学期期末化学试卷(解析版) 题型:选择题
在一个恒温恒容的密闭容器中发生如下反应,2A(g)+ B(s)  C(g)+3D(g),不能说明该反应达到平衡的是( )
C(g)+3D(g),不能说明该反应达到平衡的是( )
A.气体总质量不变 B.混合气体密度不变
C.反应物B的浓度不变 D.混合气体平均相对分子质量不再改变
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省高一第二学期期末化学试卷(解析版) 题型:选择题
下列分子只表示一种物质的是( )
A.C3H7Cl B.C5H12 C.CH2Cl2 D.C4H10
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省延安市第一学期期末考试高二化学试卷(解析版) 题型:填空题
(9分)(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为_________________________________________________。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
化学键 | C—H | C—F | H—F | F—F |
键能 | 414 | 489 | 565 | 158 |
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)= CF4(g)+4HF(g) △H=______________________。
(3) 下列说法正确的是(填序号)__ __:
A 相同温度下,0.1 mol?L-1NH4Cl溶液中NH4+的浓度比0.1 mol?L-1氨水中NH4+的浓度大;
B 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C 电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气;
D 对于Al(OH)3(s) Al(OH)3(aq)
Al(OH)3(aq) Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
E.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大;
查看答案和解析>>
科目:高中化学 来源:2013-2014陕西省延安市下学期期末考高一化学试卷(解析版) 题型:选择题
下列关于能源和作为能源的物质的叙述错误的是
A.吸热反应的反应物总能量低于生成物总能量
B.绿色植物进行光合作用时,将光能转化为化学能“贮存”起来
C.物质的化学能可以在不同条件下转为热能、电能、光能等为人类所利用
D.天然气属于二次能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com